Pembrolizumab thường liên quan nhiều nhất đến các phản ứng bất lợi liên quan đến miễn dịch. Hầu hết trong số này, bao gồm các phản ứng nghiêm trọng, đã hồi phục sau khi bắt đầu điều trị nội khoa thích hợp hoặc ngừng sử dụng pembrolizumab (xem Mô tả các phản ứng bất lợi chọn lọc dưới đây).
Độ an toàn của pembrolizumab dưới dạng đơn trị liệu đã được đánh giá ở 6.185 bệnh nhân bị melanoma tiến xa, melanoma giai đoạn III đã được cắt bỏ (điều trị bổ trợ), hoặc ung thư phổi không tế bào nhỏ (NSCLC), u lympho Hodgkin kinh điển (cHL), ung thư biểu mô đường tiết niệu, ung thư tế bào vảy vùng đầu và cổ (HNSCC), hoặc ung thư đại-trực tràng (CRC) qua 4 mức liều (2 mg/kg cân nặng mỗi 3 tuần, 200 mg mỗi 3 tuần, hoặc 10 mg/kg cân nặng mỗi 2 hoặc 3 tuần) trong các nghiên cứu lâm sàng. Các tần suất bao gồm dưới đây và trong Bảng 35 được dựa trên tất cả các phản ứng bất lợi của thuốc được báo cáo, bất kể đánh giá của nhà nghiên cứu về các căn nguyên gây ra. Ở nhóm bệnh nhân này, thời gian quan sát trung vị là 7,6 tháng (khoảng: 1 ngày đến 47 tháng) và các phản ứng bất lợi thường gặp nhất với pembrolizumab là mệt mỏi (32%), buồn nôn (21%) và tiêu chảy (21%). Đa số các phản ứng bất lợi được báo cáo đối với đơn trị liệu có mức độ là Độ 1 hoặc Độ 2. Các phản ứng bất lợi nghiêm trọng nhất là các phản ứng bất lợi liên quan đến miễn dịch và các phản ứng bất lợi liên quan đến tiêm truyền (xem phần Cảnh báo và Thận trọng).
Độ an toàn của pembrolizumab phối hợp với hóa trị liệu đã được đánh giá ở 1.437 bệnh nhân ung thư phổi không tế bào nhỏ, ung thư tế bào vảy vùng đầu và cổ, hoặc u thực quản dùng pembrolizumab 200 mg, 2 mg/kg cân nặng hoặc 10 mg/kg cân nặng mỗi 3 tuần, trong các nghiên cứu lâm sàng. Các tần suất bao gồm dưới đây và trong Bảng 35 được dựa trên tất cả các phản ứng bất lợi của thuốc được báo cáo, bất kể đánh giá của nhà nghiên cứu về căn nguyên gây ra. Ở nhóm bệnh nhân này, các phản ứng bất lợi thường gặp nhất là buồn nôn (55%), thiếu máu (51%), mệt mỏi (39%), táo bón (37%), giảm sự ngon miệng (34%), tiêu chảy (33%), giảm bạch cầu trung tính (29%), và nôn (28%). Tỷ lệ phản ứng bất lợi Độ 3-5 ở những bệnh nhân ung thư phổi không tế bào nhỏ là 67% đối với liệu pháp phối hợp pembrolizumab và 66% đối với hóa trị liệu đơn thuần, ở những bệnh nhân ung thư tế bào vảy vùng đầu và cổ là 85% đối với liệu pháp phối hợp pembrolizumab và 84% đối với hóa trị liệu kết hợp với cetuximab, và ở bệnh nhân bị ung thư biểu mô thực quản là 86% đối với liệu pháp kết hợp pembrolizumab và 83 đối với hóa trị liệu đơn thuần.
Bảng liệt kê các phản ứng bất lợi
Các phản ứng bất lợi được quan sát thấy trong các nghiên cứu lâm sàng của pembrolizumab dùng đơn trị liệu hoặc phối hợp với hóa trị liệu, hoặc được báo cáo sau khi đưa thuốc ra thị trường được liệt kê ở Bảng 35. Các phản ứng bất lợi đã biết xảy ra với pembrolizumab hoặc với hóa trị liệu đơn thuần có thể xảy ra trong quá trình điều trị với những thuốc này ở trong phác đồ phối hợp, ngay cả khi các phản ứng này không được báo cáo trong các thử nghiệm lâm sàng dùng điều trị phối hợp. Những phản ứng này được trình bày theo nhóm hệ cơ quan và theo tần suất. Tần suất được định nghĩa là: rất thường gặp (≥ 1/10); thường gặp (≥ 1/100 đến < 1/10); ít gặp (≥ 1/1.000 đến < 1/100); hiếm gặp (≥ 1/10.000 đến < 1/1.000); rất hiếm gặp (< 1/10.000), không rõ (không thể ước tính từ các dữ liệu hiện có). Trong mỗi nhóm tần suất, các phản ứng bất lợi được trình bày theo thứ tự mức độ nghiêm trọng giảm dần.
- xem Bảng 35
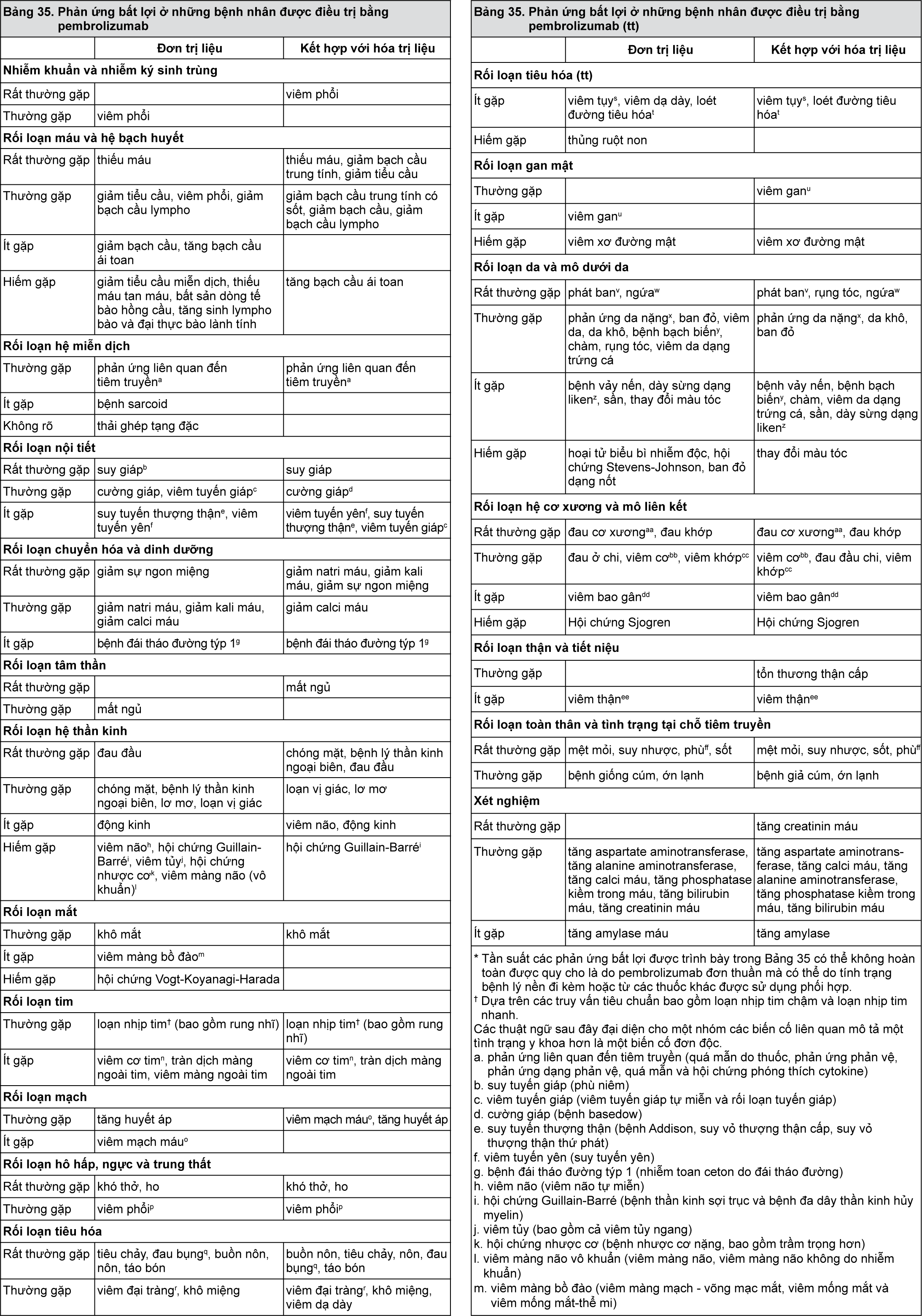

Trong một nghiên cứu thêm ở 192 bệnh nhân ung thư biểu mô tế bào vảy đầu và cổ (HNSCC) dùng pembrolizumab (KEYNOTE-012), các phản ứng bất lợi thường tương tự như được báo cáo trong Bảng 35, ngoại trừ suy tuyến giáp mới hoặc diễn tiến xấu đi. Trong các nghiên cứu bổ sung ở 259 bệnh nhân ung thư dạ dày (KEYNOTE-059), 104 bệnh nhân ung thư biểu mô tế bào gan (KEYNOTE-224), 98 bệnh nhân ung thư cổ tử cung (KEYNOTE-158) và 155 bệnh nhân ung thư mất ổn định vi vệ tinh mức độ cao (MSI-H) hoặc khiếm khuyết trong sửa chữa bắt cặp sai (dMMR) (KEYNOTE-158 và KEYNOTE-164), và 435 bệnh nhân ung thư thực quản (KEYNOTE-181 và KEYNOTE-180) các phản ứng bất lợi thường tương tự như được báo cáo trong Bảng 35.
Ở bệnh nhân bị ung thư vú bộ ba âm tính nguy cơ cao (TNBC) giai đoạn sớm dùng KEYTRUDA kết hợp với hóa trị (carboplatin và paclitaxel, sau đó là doxorubicin hoặc epirubicin và cyclophosphamide), như là một điều trị tân bổ trợ và tiếp tục điều trị bổ trợ đơn trị liệu, phản ứng có hại xảy ra ở ít nhất 20% bệnh nhân và với tỷ lệ biến cố bất lợi cao hơn (chênh lệch ≥ 5%) so sánh với bệnh nhân bị ung thư vú bộ ba âm tính điều trị bằng placebo kết hợp với hóa trị (carboplatin và paclitaxel sau đó là doxorubicin hoặc epirubicin và cyclophosphamide), như là liệu pháp điều trị tân bổ trợ và tiếp tục điều trị bổ trợ đơn trị liệu là tiêu chảy (41% so với 34%), phát ban (30% so với 24%), sốt (28% so với 19%), và giảm cảm giác thèm ăn (23% so với 17%). Trong số các phản ứng bất lợi này, biến cố bất lợi ở Độ 3 và 4 là tiêu chảy (3,2% so với 1,8%), phát ban (1,8% so với 0,3%), sốt (1,3% so với 0,3%) và giảm cảm giác thèm ăn (0,9% so với 0,3%).
Ở bệnh nhân ung thư dạ dày dùng KEYTRUDA cùng với trastuzumab và hóa trị (fluoropyrimidine và platinum), phản ứng có hại xảy ra ở ít nhất 20% bệnh nhân và ở tỷ lệ cao hơn (chênh lệch ≥ 2%) biến cố bất lợi Độ 3-4 so với placebo cùng với trastuzumbab và hóa trị (fluoropyrimidine và platinum) là: nôn (4,6% so với 1,9%), thiếu máu (14% so với 12%), giảm số lượng tiểu cầu (14% so với 10%) và giảm bạch huyết (13% so với 9%)
Mô tả chọn lọc các phản ứng bất lợi
Dữ liệu về các phản ứng bất lợi liên quan đến miễn dịch sau đây được dựa trên bệnh nhân dùng pembrolizumab qua 4 mức liều (2 mg/kg mỗi 3 tuần, 10 mg/kg mỗi 2 hoặc 3 tuần) hoặc 200 mg mỗi 3 tuần trong các nghiên cứu lâm sàng (xem phần Dược lực học). Hướng dẫn xử trí đối với những phản ứng bất lợi này được mô tả trong phần Cảnh báo và thận trọng).
Phản ứng bất lợi liên quan đến miễn dịch (xem phần Cảnh báo và thận trọng)
Viêm phổi liên quan đến miễn dịch
Viêm phổi đã xảy ra ở 286 bệnh nhân (4,6%), bao gồm các trường hợp theo thứ tự Độ 2, 3, 4 hoặc 5 ở 128 bệnh nhân (2,1%), 73 bệnh nhân (1,2%), 17 bệnh nhân (0,3%) và 9 bệnh nhân (0,1%) dùng pembrolizumab. Thời gian trung vị khởi phát viêm phổi là 3,5 tháng (khoảng: 2 ngày đến 26,7 tháng). Trung vị thời gian mắc là 2,0 tháng (khoảng: 1 ngày đến 33,0+ tháng). Viêm phổi đã xảy ra thường xuyên hơn ở những bệnh nhân có tiền sử xạ trị ở vùng lồng ngực trước đó (8,2%) so với những bệnh nhân không được xạ trị ở vùng lồng ngực trước đó (4,2%). Viêm phổi đã dẫn đến ngừng điều trị bằng pembrolizumab ở 117 bệnh nhân (1,9%). Viêm phổi đã hồi phục ở 166 bệnh nhân, 4 bệnh nhân có di chứng.
Ở những bệnh nhân ung thư phổi không tế bào nhỏ, viêm phổi đã xảy ra ở 107 bệnh nhân (4,9%), bao gồm các trường hợp Độ 2, 3, 4 hoặc 5 theo thứ tự ở 39 bệnh nhân (1,8%), 30 bệnh nhân (1,4%), 10 bệnh nhân (0,5%) và 9 bệnh nhân (0,4%). Ở những bệnh nhân ung thư phổi không tế bào nhỏ, viêm phổi đã xảy ra ở 8,1% bệnh nhân có tiền sử xạ trị lồng ngực trước đó.
Viêm đại tràng liên quan đến miễn dịch
Viêm đại tràng đã xảy ra ở 121 bệnh nhân (2,0%), bao gồm các trường hợp theo thứ tự Độ 2, 3 hoặc 4 ở 35 bệnh nhân (0,6%), 67 bệnh nhân (1,1%) và 5 bệnh nhân (< 0,1%) dùng pembrolizumab. Thời gian trung vị khởi phát viêm đại tràng là 4,7 tháng (khoảng: 7 ngày đến 24,3 tháng). Trung vị thời gian mắc là 1,0 tháng (khoảng: 1 ngày đến 12,4+ tháng). Viêm đại tràng đã dẫn đến ngừng điều trị bằng pembrolizumab ở 34 bệnh nhân (0,5%). Viêm đại tràng đã hồi phục ở 99 bệnh nhân, 2 bệnh nhân có di chứng. Ở bệnh nhân ung thư đại trực tràng (CRC) điều trị bằng pembrolizumab đơn trị liệu (n=153), tỷ lệ viêm đại tràng là 6,5% (tất cả các cấp độ) với 2,0% Độ 3 và 1,3% Độ 4.
Viêm gan liên quan đến miễn dịch
Viêm gan đã xảy ra ở 61 bệnh nhân (1,0%), bao gồm các trường hợp theo thứ tự Độ 2, 3 hoặc 4 ở 8 bệnh nhân (0,1%), 41 bệnh nhân (0,7%) và 8 bệnh nhân (< 0,1%) dùng pembrolizumab. Thời gian trung vị khởi phát viêm gan là 3,8 tháng (khoảng: 8 ngày đến 26,3 tháng). Trung vị thời gian mắc là 1,1 tháng (khoảng: 1 ngày đến 20,9+ tháng). Viêm gan đã dẫn đến ngừng điều trị bằng pembrolizumab ở 24 bệnh nhân (0,4%). Viêm gan đã hồi phục ở 46 bệnh nhân.
Viêm thận liên quan đến miễn dịch
Viêm thận đã xảy ra ở 25 bệnh nhân (0,4%), bao gồm các trường hợp theo thứ tự Độ 2, 3 hoặc 4 ở 5 bệnh nhân (0,1%), 15 bệnh nhân (0,2%) và 2 bệnh nhân (< 0,1%) dùng pembrolizumab, dưới dạng đơn trị liệu. Thời gian trung vị khởi phát viêm thận là 5,1 tháng (khoảng: 12 ngày đến 21,4 tháng). Trung vị thời gian mắc là 3,3 tháng (khoảng: 6 ngày đến 19,6 tháng). Viêm thận đã dẫn đến ngừng điều trị bằng pembrolizumab ở 10 bệnh nhân (0,2%). Viêm thận đã hồi phục ở 15 bệnh nhân, 4 bệnh nhân có di chứng. Ở những bệnh nhân ung thư phổi không tế bào nhỏ, không phải tế bào vảy được điều trị bằng pembrolizumab phối hợp với hóa trị liệu có chứa pemetrexed và platin (n=488), tỷ lệ viêm thận là 1,4% (tất cả các cấp độ) với 0,8% Độ 3 và 0,4% Độ 4.
Bệnh nội tiết liên quan đến miễn dịch
Suy tuyến thượng thận đã xảy ra ở 52 bệnh nhân (0,8%), bao gồm các trường hợp Độ 2, 3 hoặc 4 theo thứ tự ở 23 bệnh nhân (0,4%), 21 bệnh nhân (0,3%) và 4 bệnh nhân (0,1%) dùng pembrolizumab. Thời gian trung vị khởi phát suy tuyến thượng thận là 5,5 tháng (khoảng từ 1 ngày đến 23,7 tháng). Trung vị thời gian mắc chưa tính được (khoảng từ 3 ngày đến 32,4+ tháng). Suy tuyến thượng thận đã dẫn đến ngừng điều trị bằng pembrolizumab ở 5 bệnh nhân (0,1%). Suy tuyến thượng thận đã hồi phục ở 18 bệnh nhân, 5 bệnh nhân có di chứng.
Viêm tuyến yên đã xảy ra ở 38 bệnh nhân (0,6%), bao gồm các trường hợp theo thứ tự Độ 2, 3 hoặc 4 ở 15 bệnh nhân (0,2%), 19 bệnh nhân (0,3%) và 1 bệnh nhân (< 0,1%) dùng pembrolizumab. Thời gian trung vị khởi phát viêm tuyến yên là 5,9 tháng (khoảng: 1 ngày đến 17,7 tháng). Trung vị thời gian mắc là 3,3 tháng (khoảng: 3 ngày đến 30,4+ tháng). Viêm tuyến yên đã dẫn đến ngừng điều trị bằng pembrolizumab ở 9 bệnh nhân (0,1%). Viêm tuyến yên đã hồi phục ở 17 bệnh nhân, 8 bệnh nhân có di chứng.
Cường tuyến giáp đã xảy ra ở 261 bệnh nhân (4,2%), bao gồm các trường hợp theo thứ tự Độ 2 hoặc 3 ở 64 bệnh nhân (1,0 %) và 7 bệnh nhân (0,1%) dùng pembrolizumab. Thời gian trung vị khởi phát cường tuyến giáp là 1,4 tháng (khoảng: 1 ngày đến 23,2 tháng). Trung vị thời gian mắc là 1,8 tháng (khoảng: 4 ngày đến 27,6+ tháng). Cường tuyến giáp đã dẫn đến ngừng điều trị bằng pembrolizumab ở 3 bệnh nhân (0,1%). Cường tuyến giáp đã hồi phục ở 207 bệnh nhân (79,3%), 5 bệnh nhân có di chứng.
Suy tuyến giáp đã xảy ra ở 699 bệnh nhân (11,3%), bao gồm các trường hợp theo thứ tự Độ 2 hoặc Độ 3 ở 510 bệnh nhân (8,2 %) và 7 bệnh nhân (0,1%) dùng pembrolizumab. Thời gian trung vị khởi phát suy tuyến giáp là 3,4 tháng (khoảng: 1 ngày đến 25,9 tháng). Trung vị thời gian mắc chưa tính được (khoảng: 2 ngày đến 53,9+ tháng). 2 bệnh nhân (< 0,1%) đã ngừng điều trị bằng pembrolizumab do suy tuyến giáp. Suy tuyến giáp đã hồi phục ở 171 bệnh nhân (24,5%), 14 bệnh nhân có di chứng. Ở những bệnh nhân u lympho Hodgkin kinh điển (cHL) (n=389), tỷ lệ suy tuyến giáp là 17% (tất cả ở Độ 1 hoặc 2). Ở những bệnh nhân ung thư biểu mô tế bào vảy đầu và cổ (HNSCC) được điều trị bằng pembrolizumab dưới dạng đơn trị liệu (n=909), tỷ lệ suy tuyến giáp là 16,1% (tất cả các cấp độ) với Độ 3 là 0,3%. Ở những bệnh nhân ung thư tế bào vảy đầu và cổ điều trị bằng pembrolizumab phối hợp với hóa trị liệu có chứa platin và 5-FU (n=276), tỷ lệ suy tuyến giáp là 15,2%, tất cả đều là độ 1 hoặc 2.
Phản ứng bất lợi ở da liên quan đến miễn dịch
Các phản ứng da nặng liên quan đến miễn dịch đã xảy ra ở 102 bệnh nhân (1,6%), bao gồm các trường hợp Độ 2, 3 hoặc 5 theo thứ tự ở 11 bệnh nhân (0,2%), 77 bệnh nhân (1,2%) và 1 bệnh nhân (< 0,1%) dùng pembrolizumab. Thời gian trung vị khởi phát phản ứng da nặng là 3,5 tháng (khoảng từ 3 ngày đến 19,4 tháng). Trung vị thời gian mắc là 1,9 tháng (khoảng từ 1 ngày đến 33,0+ tháng). Các phản ứng da nặng dẫn đến ngừng điều trị bằng pembrolizumab ở 13 bệnh nhân (0,2%). Các phản ứng da nặng đã hồi phục ở 71 bệnh nhân, 1 bệnh nhân có di chứng.
Các trường hợp hiếm gặp về hội chứng Stevens-Johnson (SJS) và hoại tử biểu bì nhiễm độc (TEN), một số trường hợp có kết cuộc tử vong, đã được quan sát thấy (xem phần Liều lượng và cách dùng và Cảnh báo và Thận trọng).
Nhóm bệnh nhân trẻ em
Độ an toàn của pembrolizumab dưới dạng đơn trị liệu đã được đánh giá ở 161 bệnh nhân trẻ em tuổi từ 9 tháng đến 17 tuổi mắc ung thư melanoma tiến triển, u lympho hoặc khối u đặc biểu hiện PD-L1 dương tính tiến triển, tái phát hoặc kháng trị với liều 2 mg/kg mỗi 3 tuần trong nghiên cứu pha I/II KEYNOTE-051. Nhóm bệnh nhân u lympho Hodgkin kinh điển (cHL) bao gồm bệnh nhân từ 11 đến 17 tuổi. Hồ sơ về an toàn ở những bệnh nhân trẻ em thường tương tự như ở người lớn được điều trị bằng pembrolizumab. Các phản ứng bất lợi thường gặp nhất (được báo cáo ở ít nhất 20% bệnh nhân trẻ em) là sốt (33%), nôn (30%), nhức đầu (26%), đau bụng (22%), thiếu máu (21%) ho (21%) và táo bón (20%). Đa số các phản ứng bất lợi được báo cáo đối với đơn trị liệu có mức độ nặng là độ 1 hoặc 2. 76 bệnh nhân (47,2%) có 1 hoặc nhiều phản ứng bất lợi độ 3 đến 5, trong đó 5 bệnh nhân (3,1%) có 1 hoặc nhiều phản ứng bất lợi dẫn đến tử vong. Các tần suất được dựa trên tất cả các phản ứng bất lợi của thuốc được báo cáo, bất kể đánh giá của nhà nghiên cứu về quan hệ nhân quả.
View ADR Monitoring Form




 Đăng xuất
Đăng xuất

