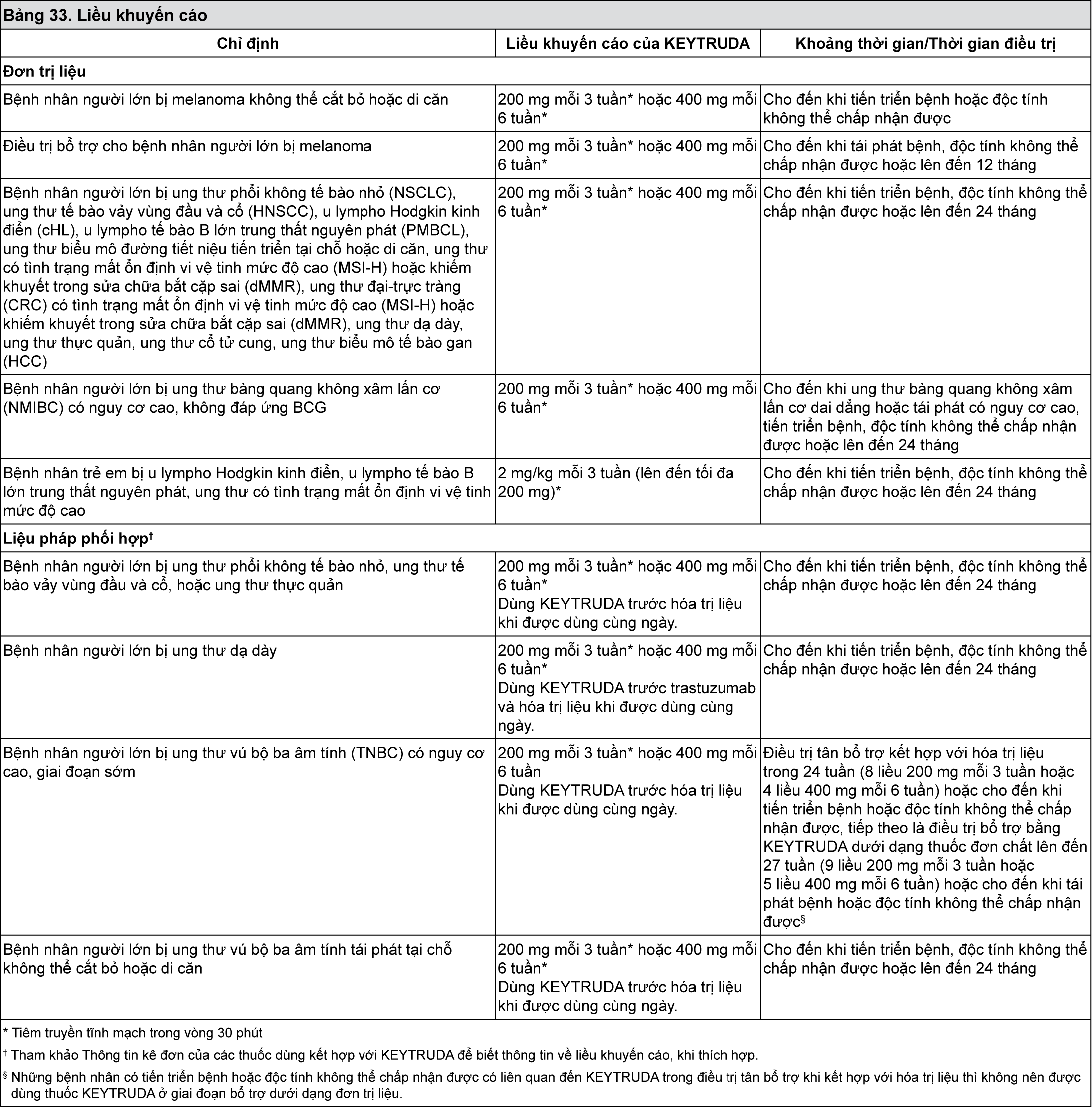
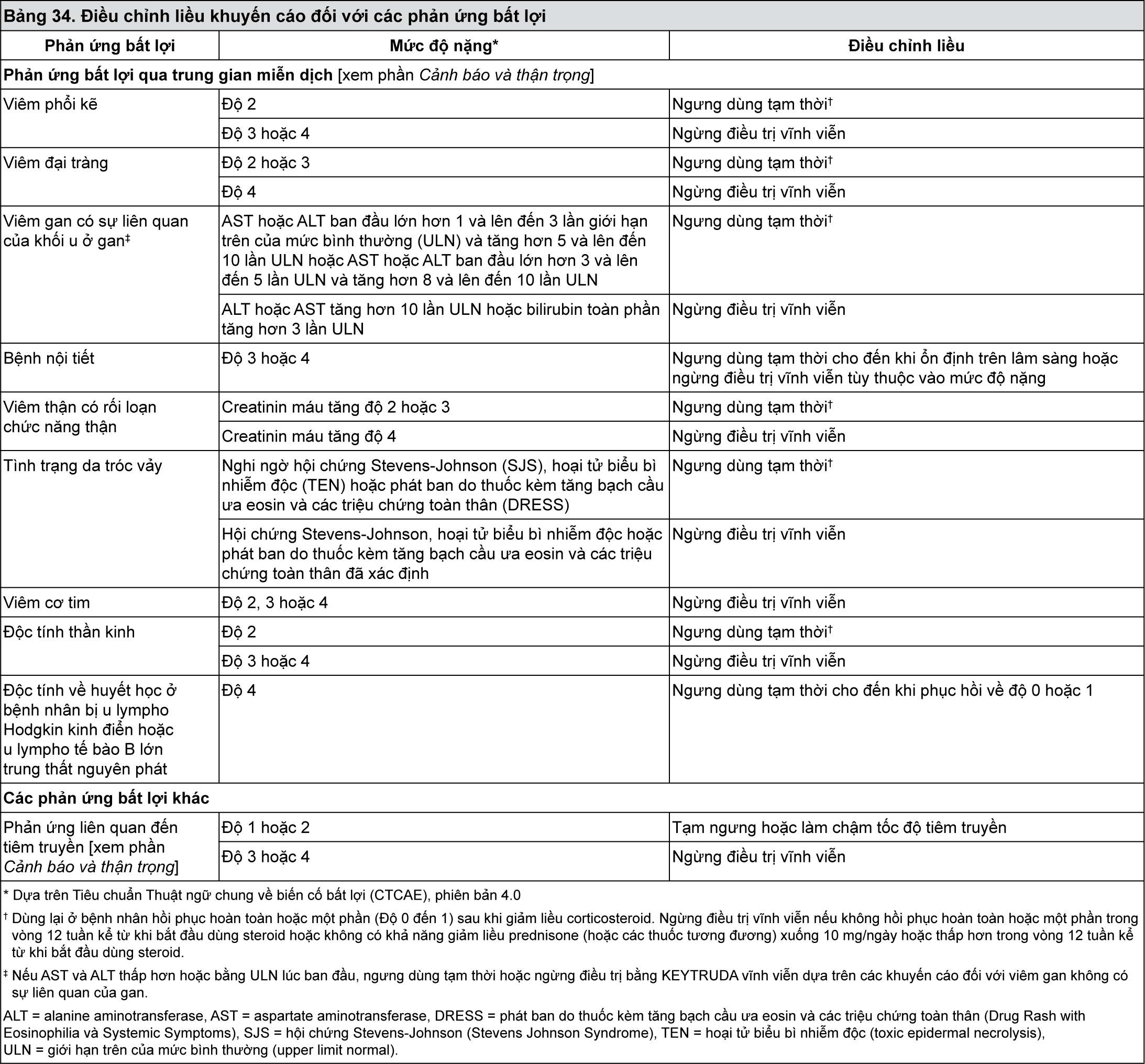
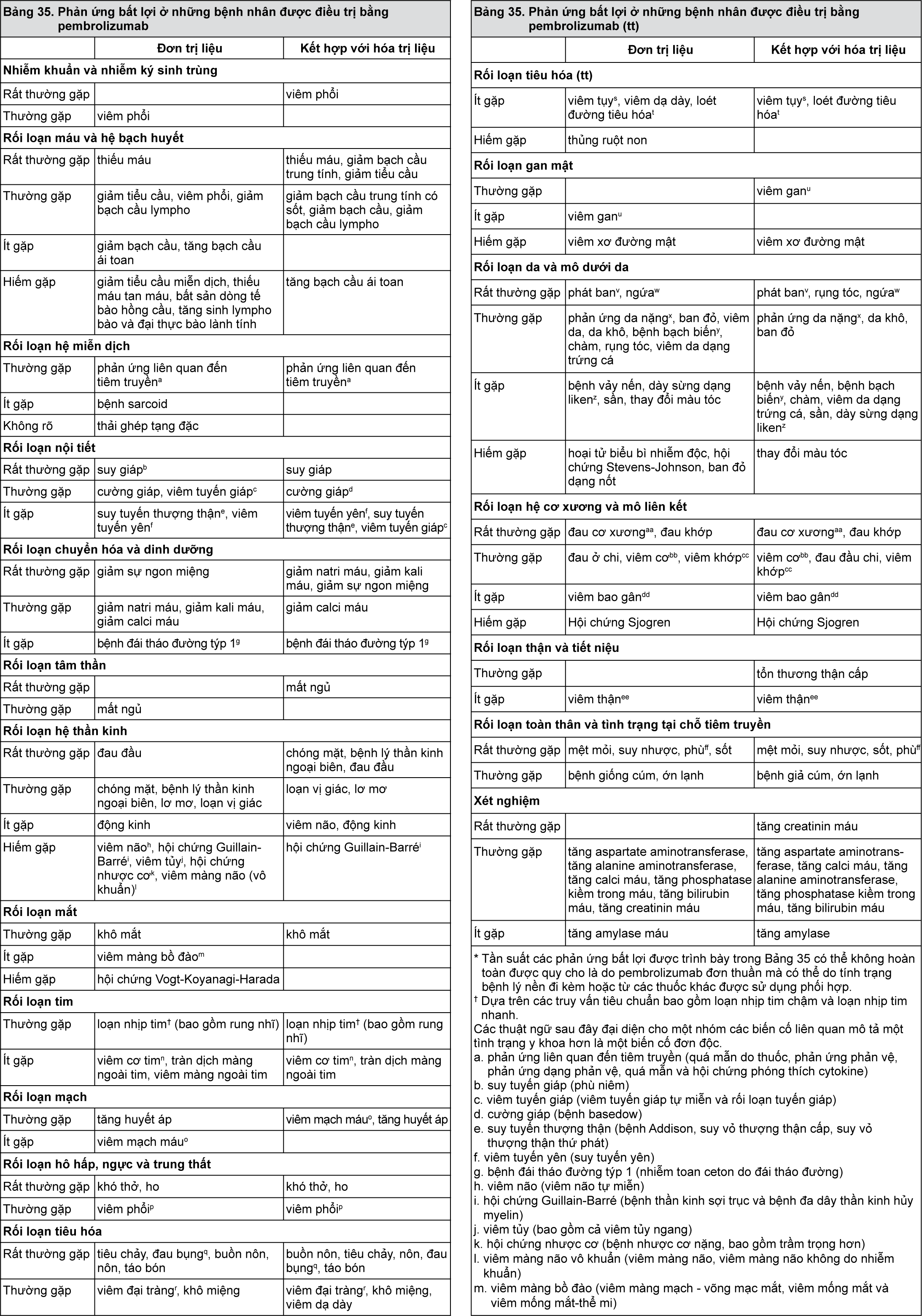
Nhóm dược lý trị liệu: Thuốc chống ung thư, kháng thể đơn dòng.
Mã ATC: L01XC18.
Cơ chế tác dụng
KEYTRUDA là một kháng thể đơn dòng được nhân hóa gắn với thụ thể chết tế bào theo lập trình-1 (programmed cell death-1) (PD-1) và ngăn chặn sự tương tác của nó với các phối tử PD-L1 và PD-L2. Thụ thể PD-1 là yếu tố điều hòa âm tính hoạt động của tế bào lympho T - đã được chứng minh là có liên quan đến việc kiểm soát đáp ứng miễn dịch của tế bào lympho T. KEYTRUDA làm tăng đáp ứng của tế bào T, bao gồm đáp ứng kháng khối u, thông qua việc cản trở sự gắn kết PD-1 với PD-L1 và PD-L2, được biểu hiện trong các tế bào trình diện kháng nguyên và có thể được biểu hiện bởi khối u hoặc các tế bào khác trong vi môi trường của khối u.
Hiệu quả và an toàn lâm sàng
Liều dùng đối với bệnh nhân bị melanoma và ung thư phổi không tế bào nhỏ đã được điều trị trước đây
Trong các nghiên cứu lâm sàng so sánh pembrolizumab liều 2 mg/kg mỗi 3 tuần, 10 mg/kg mỗi 3 tuần và 10 mg/kg mỗi 2 tuần ở những bệnh nhân bị melanoma hoặc bệnh nhân ung thư phổi không tế bào nhỏ đã được điều trị trước đây, hiệu quả và độ an toàn tương tự nhau. Liều khuyến cáo là 2 mg/kg mỗi 3 tuần.
MELANOMA
KEYNOTE-006: Thử nghiệm có đối chứng ở bệnh nhân bị melanoma chưa từng điều trị bằng ipilimumab
Độ an toàn và hiệu quả của pembrolizumab đã được khảo sát trong nghiên cứu KEYNOTE-006 đa trung tâm, có đối chứng, pha III trong điều trị melanoma tiến triển ở bệnh nhân chưa từng điều trị bằng ipilimumab. Các bệnh nhân được chọn ngẫu nhiên (1:1:1) dùng pembrolizumab 10 mg/kg mỗi 2 tuần (n=279) hoặc 3 tuần (n=277) hoặc ipilimumab 3 mg/kg mỗi 3 tuần (n=278). Những bệnh nhân bị melanoma có đột biến BRAF V600E không được yêu cầu phải điều trị trước bằng thuốc ức chế BRAF.
Các bệnh nhân được điều trị bằng pembrolizumab cho đến khi tiến triển bệnh hoặc độc tính không thể chấp nhận được. Những bệnh nhân ổn định trên lâm sàng có bằng chứng ban đầu về tiến triển bệnh được phép duy trì điều trị cho đến khi sự tiến triển bệnh được xác định. Đánh giá tình trạng khối u được thực hiện lúc 12 tuần, sau đó mỗi 6 tuần cho đến tuần thứ 48, tiếp theo là mỗi 12 tuần sau đó.
Trong số 834 bệnh nhân, 60% là nam giới, 44% ≥ 65 tuổi (tuổi trung vị là 62 tuổi [khoảng từ 18-89]) và 98% là người da trắng. 65% bệnh nhân bị giai đoạn M1c, 9% có tiền sử di căn não, 66% không có điều trị trước và 34% có một điều trị trước. 31% có điểm số tình trạng hoạt động cơ thể theo thang điểm của Nhóm hợp tác nghiên cứu ung thư miền đông nước Mỹ (ECOG) là 1, 69% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 và 32% có tăng LDH. Đột biến BRAF đã được báo cáo ở 302 bệnh nhân (36%). Trong số những bệnh nhân có khối u đột biến BRAF, 139 bệnh nhân (46%) đã điều trị trước đây bằng một thuốc ức chế BRAF.
Đánh giá kết quả về hiệu quả chính là thời gian sống còn không tiến triển bệnh (PFS; như được đánh giá bằng xem xét Đánh giá kết hợp về X-quang và ung thư [IRO] sử dụng tiêu chuẩn đánh giá đáp ứng về khối u đặc [RECIST], phiên bản 1.1) và thời gian sống còn toàn bộ (OS). Đánh giá kết quả về hiệu quả phụ là tỷ lệ đáp ứng toàn bộ (ORR) và thời gian đáp ứng.
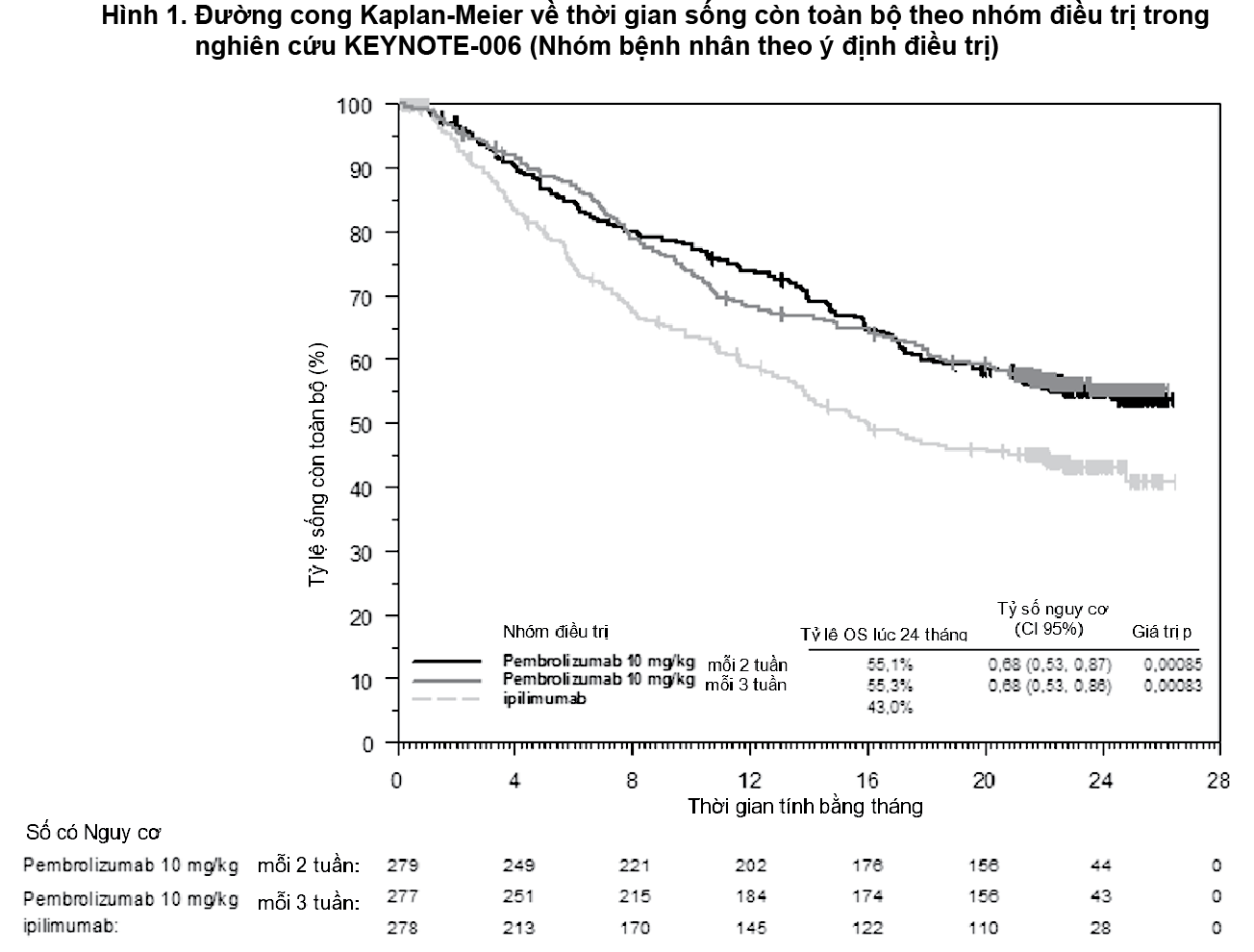
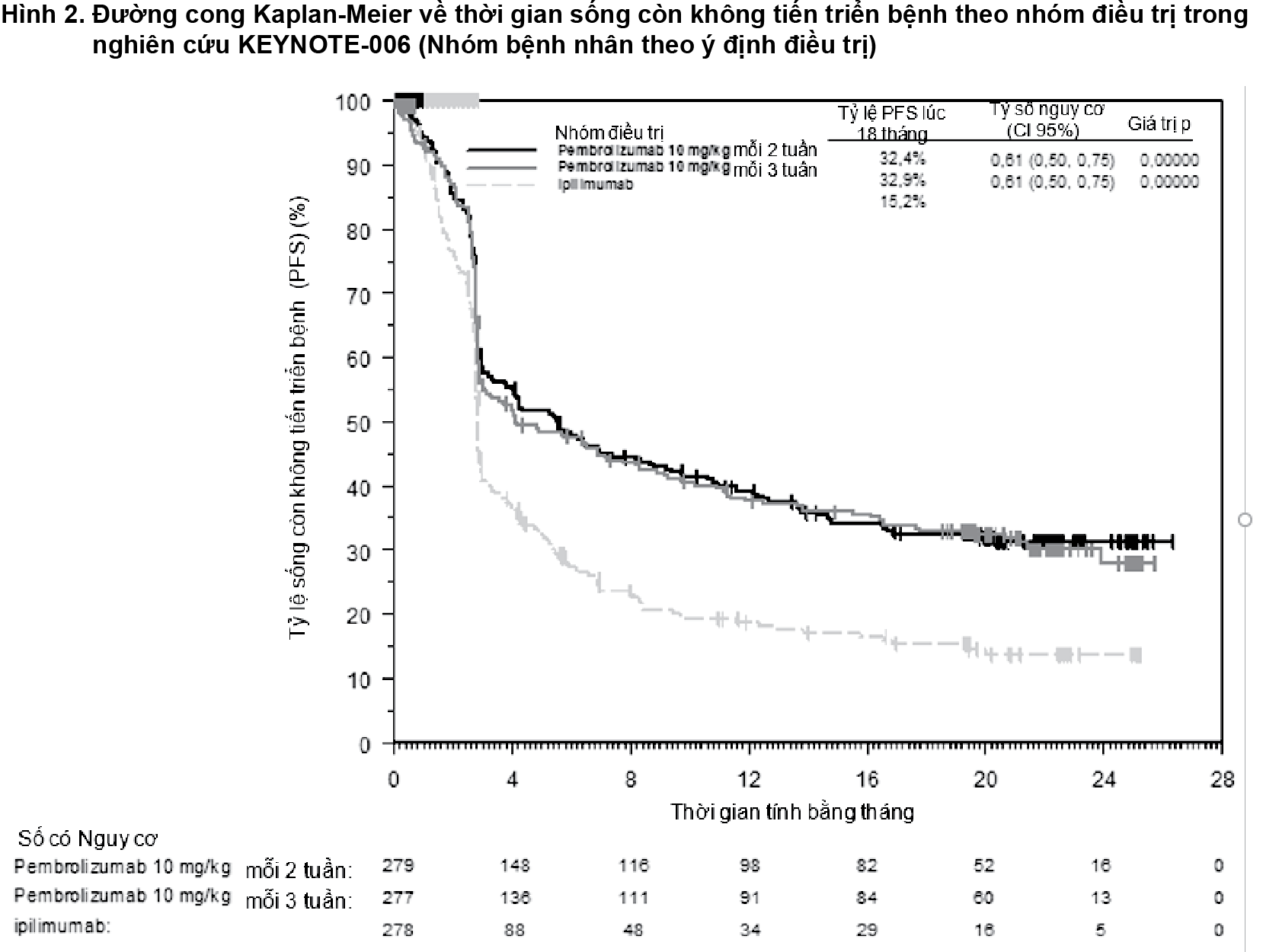
Bảng 1 tóm tắt các đánh giá về hiệu quả chính ở những bệnh nhân chưa từng điều trị bằng ipilimumab, ở phân tích cuối cùng được thực hiện sau tối thiểu 21 tháng theo dõi. Đường cong Kaplan-Meier về thời gian sống còn toàn bộ và thời gian sống còn không tiến triển bệnh dựa trên phân tích cuối cùng được thể hiện trong
Hình 1 và 2.
- xem Bảng 1.
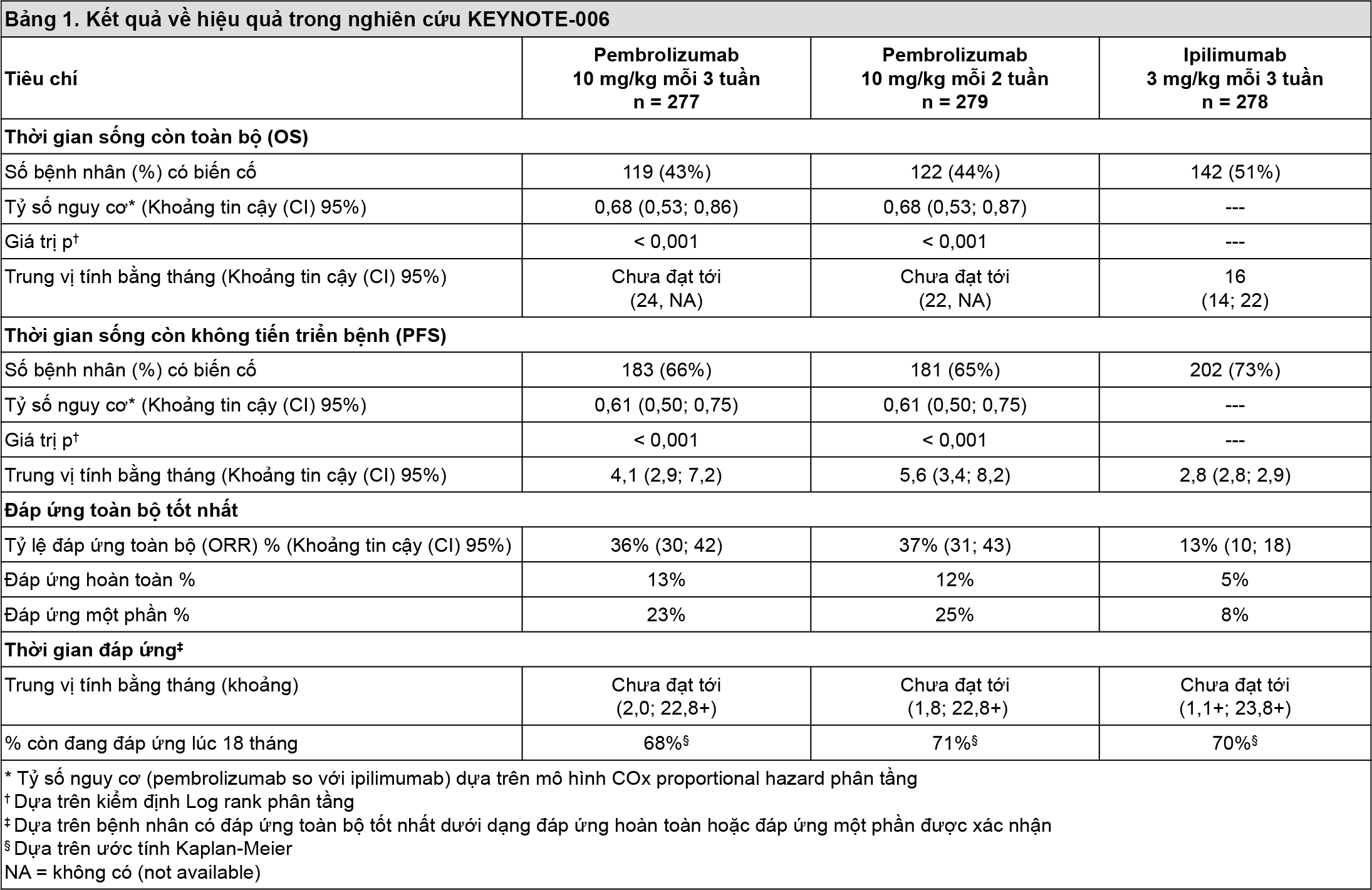
- xem Hình 1 và 2.
 KEYNOTE-002: Thử nghiệm có đối chứng ở bệnh nhân bị melanoma đã điều trị trước đây bằng ipilimumab
KEYNOTE-002: Thử nghiệm có đối chứng ở bệnh nhân bị melanoma đã điều trị trước đây bằng ipilimumab
Độ an toàn và hiệu quả của pembrolizumab đã được khảo sát trong nghiên cứu KEYNOTE-002, một nghiên cứu đa trung tâm, có đối chứng trong điều trị melanoma tiến triển ở bệnh nhân đã điều trị trước đây bằng ipilimumab và với thuốc ức chế BRAF hoặc thuốc ức chế MEK nếu đột biến BRAF V600 dương tính. Các bệnh nhân được chọn ngẫu nhiên (1:1:1) để dùng pembrolizumab ở liều 2 mg/kg (n=180) hoặc 10 mg/kg (n=181) mỗi 3 tuần hoặc hóa trị liệu (n=179; bao gồm dacarbazine, temozolomide, carboplatin, paclitaxel hoặc carboplatin+paclitaxel). Nghiên cứu đã loại trừ những bệnh nhân bị bệnh tự miễn hoặc những người đang được điều trị ức chế miễn dịch; tiêu chuẩn loại trừ thêm là tiền sử có phản ứng bất lợi liên quan đến miễn dịch nặng hoặc đe dọa tính mạng do điều trị bằng ipilimumab, được định nghĩa là bất kỳ độc tính Độ 4 hoặc độc tính Độ 3 đòi hỏi phải điều trị bằng corticosteroid (prednisone > 10 mg/ngày hoặc liều tương đương) trong hơn 12 tuần; phản ứng bất lợi liên tục ≥ Độ 2 từ điều trị trước đó bằng ipilimumab; quá mẫn nặng trước đây với các kháng thể đơn dòng khác; tiền sử viêm phổi hoặc bệnh phổi kẽ; nhiễm HIV, nhiễm virus viêm gan B hoặc nhiễm virus viêm gan C và điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG ≥ 2.
Các bệnh nhân được điều trị bằng pembrolizumab cho đến khi tiến triển bệnh hoặc độc tính không thể chấp nhận được. Những bệnh nhân ổn định trên lâm sàng có bằng chứng ban đầu về tiến triển bệnh được phép duy trì điều trị cho đến khi sự tiến triển bệnh được xác định. Đánh giá tình trạng khối u được thực hiện lúc 12 tuần, sau đó mỗi 6 tuần cho đến tuần thứ 48, tiếp theo là mỗi 12 tuần sau đó. Những bệnh nhân đang dùng hóa trị liệu có tiến triển bệnh đã được xác nhận bằng đánh giá độc lập sau khi đánh giá bệnh theo lịch trình đầu tiên có thể bắt chéo và dùng 2 mg/kg hoặc 10 mg/kg pembrolizumab mỗi 3 tuần theo cách thức mù đôi.
Trong số 540 bệnh nhân, 61% là nam giới, 43% ≥ 65 tuổi (tuổi trung vị là 62 tuổi [khoảng từ 15-89]) và 98% là người da trắng. 82% bệnh nhân bị bệnh giai đoạn M1c, 73% có ít nhất 2 điều trị toàn thân trước đó và 32% bệnh nhân có 3 điều trị toàn thân hoặc nhiều hơn trước đó đối với melanoma tiến triển. 45% có điểm số tình trạng hoạt động cơ thể theo thang điểm của Nhóm hợp tác nghiên cứu ung thư miền đông nước Mỹ (ECOG) là 1, 40% có tăng LDH và 23% có khối u đột biến BRAF.
Đánh giá kết quả về hiệu quả chính là thời gian sống còn không tiến triển bệnh (PFS) như được đánh giá bởi xem xét Đánh giá kết hợp về X-quang và ung thư [IRO] sử dụng tiêu chuẩn đánh giá đáp ứng về khối u đặc [RECIST], phiên bản 1.1) và thời gian sống còn toàn bộ (OS). Đánh giá kết quả về hiệu quả phụ là tỷ lệ đáp ứng toàn bộ (ORR) và thời gian đáp ứng.
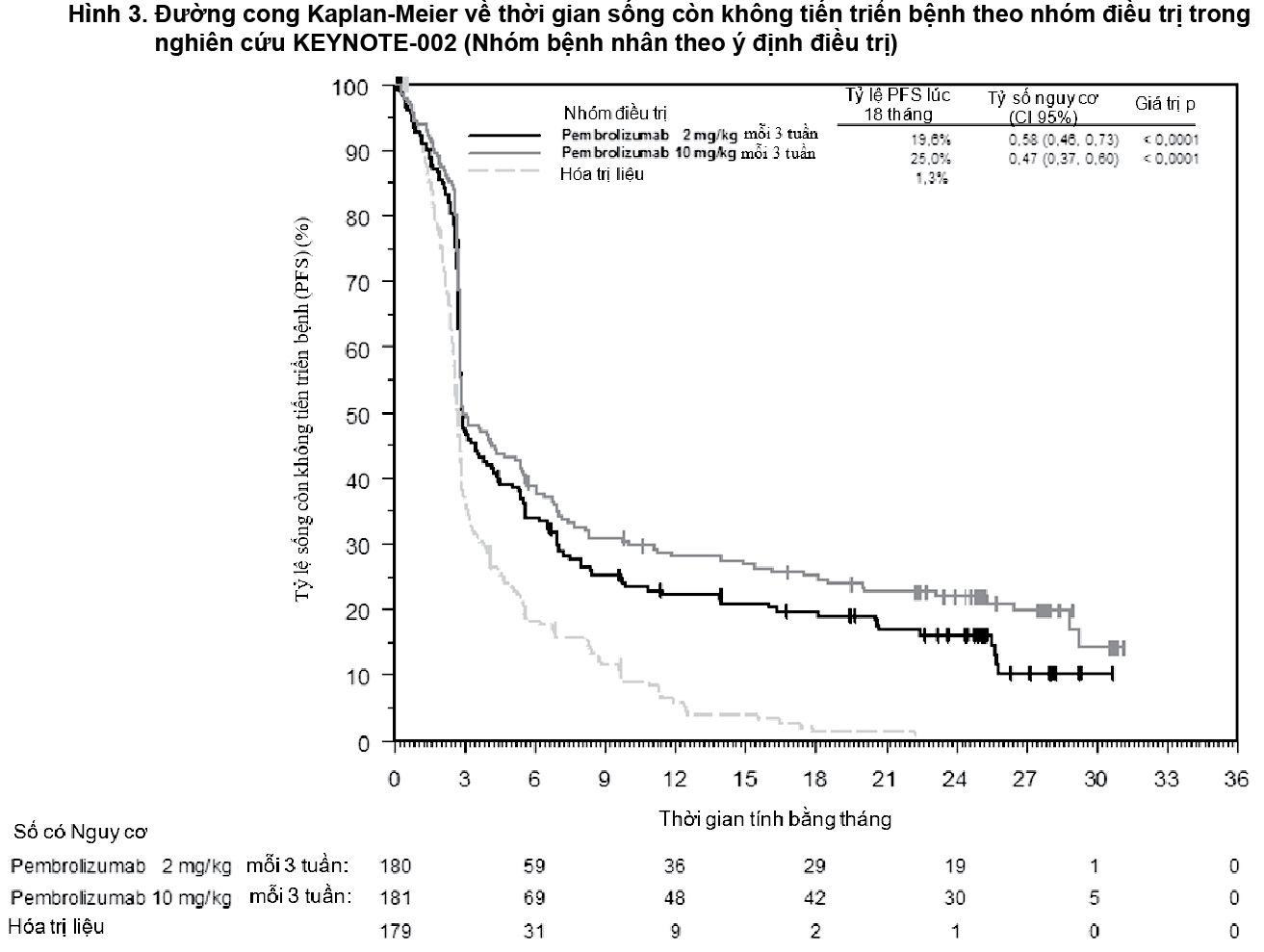
Bảng 2 tóm tắt các đánh giá về hiệu quả chính ở phân tích cuối cùng trên những bệnh nhân đã điều trị trước đây bằng ipilimumab, và đường cong Kaplan-Meier về thời gian sống còn không tiến triển bệnh được thể hiện trong
Hình 3. Cả hai nhóm dùng pembrolizumab trội hơn nhóm dùng hóa trị liệu về thời gian sống còn không tiến triển bệnh và không có sự khác biệt giữa các liều pembrolizumab. Không có sự khác biệt có ý nghĩa thống kê giữa pembrolizumab và hóa trị liệu trong phân tích cuối cùng về thời gian sống còn toàn bộ mà chưa được điều chỉnh về ảnh hưởng có khả năng gây nhiễu của việc bắt chéo. Trong số những bệnh nhân được chọn ngẫu nhiên vào nhóm dùng hóa trị liệu, 55% được bắt chéo và sau đó được điều trị bằng pembrolizumab.
- xem Bảng 2
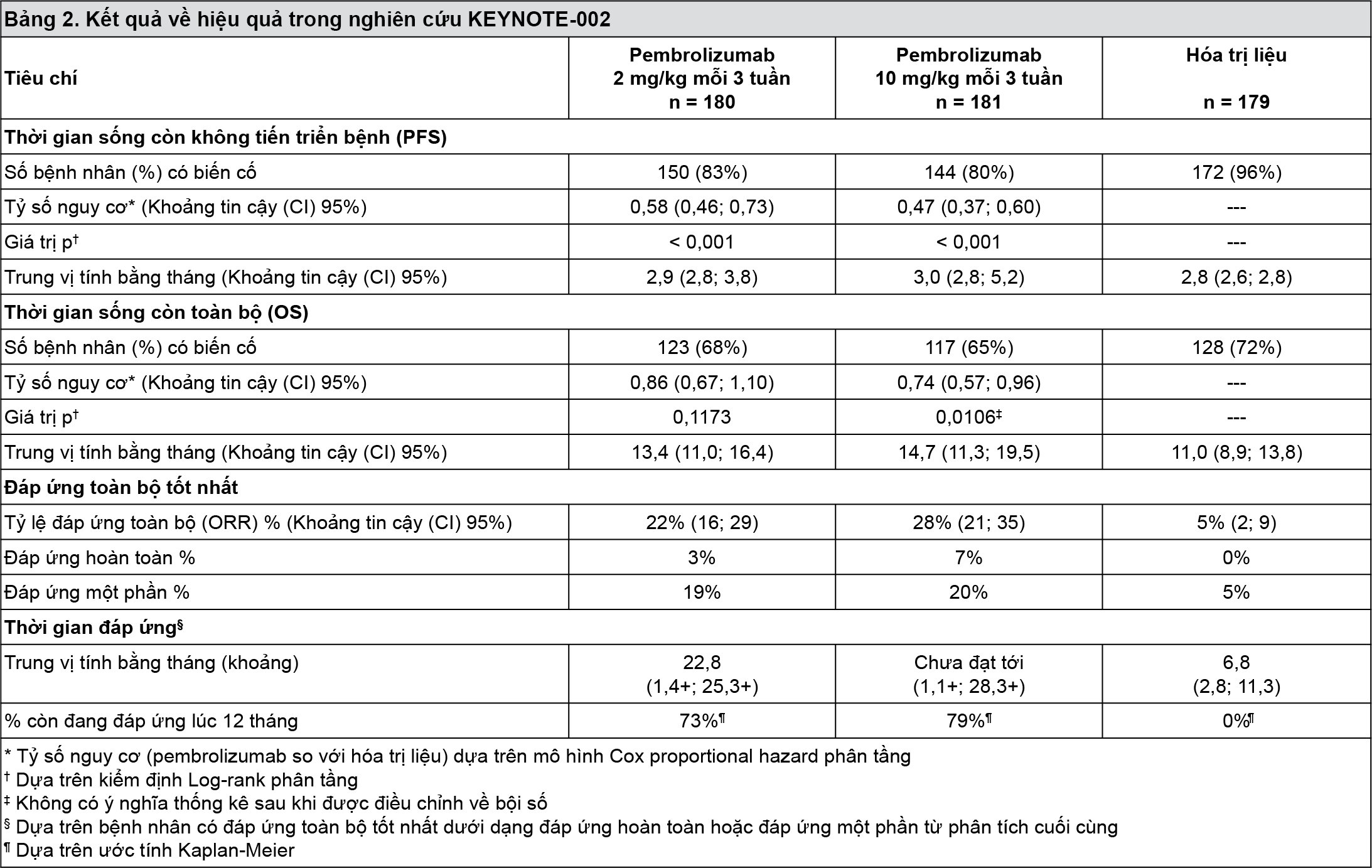
- xem Hình 3
 KEYNOTE-001: Nghiên cứu nhãn mở ở bệnh nhân bị melanoma chưa từng điều trị và đã điều trị trước đây bằng ipilimumab
KEYNOTE-001: Nghiên cứu nhãn mở ở bệnh nhân bị melanoma chưa từng điều trị và đã điều trị trước đây bằng ipilimumab
Độ an toàn và hiệu quả của pembrolizumab đối với bệnh nhân bị melanoma tiến triển đã được khảo sát trong một nghiên cứu không đối chứng, nhãn mở, KEYNOTE-001. Hiệu quả đã được đánh giá ở 276 bệnh nhân từ 2 đoàn hệ đã xác định, một đoàn hệ bao gồm những bệnh nhân đã điều trị trước đây bằng ipilimumab (và với thuốc ức chế BRAF hoặc thuốc ức chế MEK nếu đột biến BRAF V600 dương tính) và một đoàn hệ khác bao gồm những bệnh nhân chưa từng điều trị bằng ipilimumab. Các bệnh nhân được phân ngẫu nhiên để dùng pembrolizumab ở liều 2 mg/kg mỗi 3 tuần hoặc 10 mg/kg mỗi 3 tuần. Các bệnh nhân được điều trị bằng pembrolizumab cho đến khi tiến triển bệnh hoặc độc tính không thể chấp nhận được. Những bệnh nhân ổn định trên lâm sàng có bằng chứng ban đầu về tiến triển bệnh được phép duy trì điều trị cho đến khi sự tiến triển bệnh được xác định. Tiêu chuẩn loại trừ tương tự như ở nghiên cứu KEYNOTE-002.
Trong số 89 bệnh nhân dùng 2 mg/kg pembrolizumab là những người đã điều trị trước đây bằng ipilimumab, 53% là nam giới, 33% ≥ 65 tuổi và tuổi trung vị là 59 tuổi (khoảng từ 18-88). Tất cả là người da trắng trừ 2 bệnh nhân. 84% bệnh nhân bị bệnh giai đoạn M1c và 8% bệnh nhân có tiền sử di căn não. 70% có ít nhất 2 điều trị toàn thân trước đó và 35% bệnh nhân có 3 điều trị toàn thân hoặc nhiều hơn trước đó đối với melanoma tiến triển. Đột biến BRAF đã được báo cáo ở 13% của nhóm bệnh nhân nghiên cứu. Tất cả bệnh nhân có khối u đột biến BRAF đã điều trị trước đây bằng một thuốc ức chế BRAF.
Trong số 51 bệnh nhân dùng 2 mg/kg pembrolizumab là những người chưa từng điều trị bằng ipilimumab, 63% là nam giới, 35% ≥ 65 tuổi và tuổi trung vị là 60 tuổi (khoảng từ 35-80). Tất cả là người da trắng trừ 1 bệnh nhân. 63% đã có giai đoạn M1c và 2% bệnh nhân có tiền sử di căn não. 45% bệnh nhân không có điều trị trước đối với melanoma tiến triển. Đột biến BRAF đã được báo cáo ở 20 bệnh nhân (39%). Trong số những bệnh nhân có khối u đột biến BRAF, 10 bệnh nhân (50%) đã được điều trị trước đây bằng một thuốc ức chế BRAF.
Đánh giá kết quả về hiệu quả chính là tỷ lệ đáp ứng toàn bộ (ORR) như được đánh giá bởi xem xét độc lập sử dụng tiêu chuẩn đánh giá đáp ứng về khối u đặc [RECIST], phiên bản 1.1. Đánh giá kết quả về hiệu quả phụ là tỷ lệ kiểm soát bệnh (DCR; bao gồm đáp ứng hoàn toàn, đáp ứng một phần và bệnh ổn định), thời gian đáp ứng, thời gian sống còn không tiến triển bệnh (PFS) và thời gian sống còn toàn bộ (OS). Đáp ứng của khối u được đánh giá ở các khoảng cách 12 tuần.
Bảng 3 tóm tắt các đánh giá về hiệu quả chính ở những bệnh nhân đã điều trị trước đây hoặc chưa từng điều trị bằng ipilimumab, dùng pembrolizumab ở liều khuyến cáo dựa trên một thời gian theo dõi tối thiểu là 30 tháng đối với tất cả bệnh nhân.
- xem Bảng 3

Kết
quả đối với những bệnh nhân đã điều trị trước đây bằng ipilimumab (n=84) và
những bệnh nhân chưa từng điều trị bằng ipilimumab (n=52) dùng 10 mg/kg
pembrolizumab mỗi 3 tuần tương tự như đã quan sát thấy ở những bệnh nhân dùng 2
mg/kg pembrolizumab mỗi 3 tuần.
Phân tích phân nhóm bệnh nhân
• Tình trạng đột biến BRAF trong melanoma
Một phân tích phân nhóm đã được thực hiện như một phần của phân tích cuối cùng của nghiên cứu KEYNOTE-002 ở những bệnh nhân có BRAF kiểu dại (n=414; 77%) hoặc đột biến BRAF có điều trị BRAF trước (n=126; 23%) như được tóm tắt trong
Bảng 4.
- xem Bảng 4

Một phân tích phân nhóm đã được thực hiện như một phần của phân tích cuối cùng của nghiên cứu KEYNOTE-006 ở những bệnh nhân có BRAF kiểu dại (n=525; 63%), đột biến BRAF không có điều trị BRAF trước (n=163; 20%) và đột biến BRAF có điều trị BRAF trước (n=139; 17%) như được tóm tắt trong
Bảng 5.
- xem Bảng 5
 • Tình trạng PD-L1 trong melanoma
• Tình trạng PD-L1 trong melanoma
Một phân tích phân nhóm đã được thực hiện như một phần của phân tích cuối cùng của nghiên cứu KEYNOTE-002 ở những bệnh nhân có PD-L1 dương tính (biểu hiện PD-L1 ở ≥ 1% khối u và tế bào miễn dịch liên quan đến khối u) so với PD-L1 âm tính. Biểu hiện PD-L1 đã được kiểm định hồi cứu bằng thử nghiệm nghiên cứu hóa mô miễn dịch với kháng thể 22C3 kháng PD-L1. Ở những bệnh nhân có thể đánh giá được về biểu hiện PD-L1 (79%), 69% (n=294) có PD-L1 dương tính và 31% (n=134) có PD-L1 âm tính.
Bảng 6 tóm tắt kết quả về hiệu quả theo biểu hiện PD-L1.
- xem Bảng 6

Một phân tích phân nhóm đã được thực hiện như một phần của phân tích cuối cùng của nghiên cứu KEYNOTE-006 ở những bệnh nhân có PD-L1 dương tính (n=671; 80%) so với PD-L1 âm tính (n=150; 18%). Ở những bệnh nhân có thể đánh giá được về biểu hiện PD-L1 (98%), 82% có PD-L1 dương tính và 18% có PD-L1 âm tính.
Bảng 7 tóm tắt kết quả về hiệu quả theo biểu hiện PD-L1.
- xem Bảng 7
 • Melanoma ở mắt
• Melanoma ở mắt
Ở 20 đối tượng bị melanoma ở mắt được bao gồm trong nghiên cứu KEYNOTE-001, không có đáp ứng mục tiêu nào được báo cáo; bệnh ổn định đã được báo cáo ở 6 bệnh nhân.
KEYNOTE-054: Thử nghiệm đối chứng với giả dược trong điều trị bổ trợ cho các bệnh nhân bị melanoma đã được cắt bỏ hoàn toàn
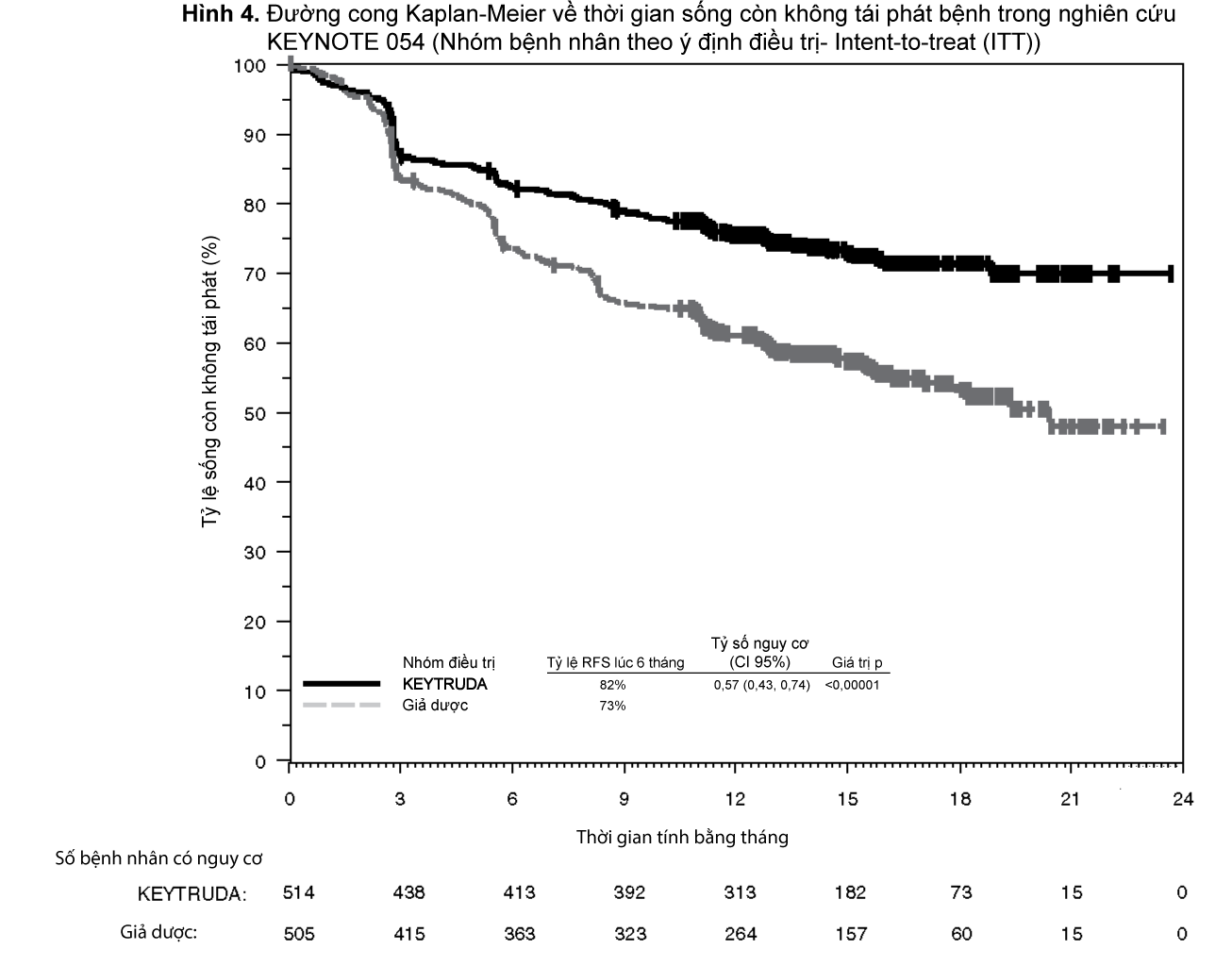
Hiệu quả của KEYTRUDA đã được đánh giá trong nghiên cứu KEYNOTE 054 là một thử nghiệm đa trung tâm, ngẫu nhiên, mù đôi, đối chứng với giả dược ở những bệnh nhân bị melanoma giai đoạn IIIA (di căn hạch bạch huyết > 1 mm), IIIB hoặc IIIC đã được cắt bỏ hoàn toàn. Tổng cộng có 1.019 bệnh nhân được phân ngẫu nhiên (1:1) dùng KEYTRUDA 200 mg mỗi 3 tuần (n=514) hoặc giả dược (n=505) đến 1 năm cho đến khi bệnh tái phát hoặc độc tính không thể chấp nhận được. Sự phân nhóm ngẫu nhiên được phân tầng bởi Ủy ban liên kết về ung thư của Mỹ (American Joint Committee on Cancer – AJCC) về giai đoạn, phiên bản thứ 7 (IIIA so với IIIB so với IIIC 1-3 hạch bạch huyết dương tính so với IIIC ≥ 4 hạch bạch huyết dương tính) và vùng địa lý (Bắc Mỹ, các nước châu Âu, Úc, và các nước khác như được chỉ định). Các bệnh nhân phải trải qua phẫu thuật cắt bỏ hạch bạch huyết và, nếu được chỉ định, xạ trị trong vòng 13 tuần trước khi bắt đầu điều trị. Những bệnh nhân bị mắc bệnh tự miễn đang hoạt động hoặc một tình trạng y khoa đòi hỏi phải điều trị bằng thuốc ức chế miễn dịch hoặc melanoma ở vị trí niêm mạc hoặc mắt là không đủ điều kiện tham gia nghiên cứu. Các bệnh nhân được theo dõi bằng chẩn đoán hình ảnh mỗi 12 tuần sau liều KEYTRUDA đầu tiên trong 2 năm đầu, sau đó mỗi 6 tháng từ năm thứ 3 đến năm thứ 5, và sau đó hàng năm.
Trong số 1.019 bệnh nhân, các đặc điểm ban đầu là: tuổi trung vị là 54 tuổi (25% từ 65 tuổi trở lên); 62% là nam giới; điểm số tình trạng hoạt động cơ thể theo thang điểm của Nhóm hợp tác nghiên cứu ung thư miền đông nước Mỹ (ECOG PS) là 0 (94%) và 1 (6%). 16% có giai đoạn IIIA; 46% có giai đoạn IIIB; 18% có giai đoạn IIIC (1-3 hạch bạch huyết dương tính) và 20% có giai đoạn IIIC (≥ 4 hạch bạch huyết dương tính); 50% có đột biến BRAF V600 dương tính và 44% có BRAF thể hoang dại; 84% bị melanoma có PD-L1 dương tính với điểm số tỷ lệ khối u (TPS ≥ 1%) theo một loại xét nghiệm chỉ dùng cho nghiên cứu (investigational use only - IUO).
Kết quả chính về hiệu quả là thời gian sống không tái phát bệnh (RFS) do đánh giá của nghiên cứu viên trong toàn bộ nhóm dân số nghiên cứu và ở nhóm bệnh nhân có khối u biểu hiện PD-L1 dương tính trong đó RFS được định nghĩa là thời gian từ ngày phân ngẫu nhiên đến ngày tái phát đầu tiên (di căn tại chỗ, vùng hoặc xa) hoặc tử vong, tùy theo trường hợp nào xảy ra trước. Thử nghiệm đã cho thấy sự cải thiện có ý nghĩa thống kê về thời gian sống còn không tái phát đối với những bệnh nhân được phân ngẫu nhiên vào nhóm dùng KEYTRUDA so với giả dược. Kết quả về hiệu quả được tóm tắt trong
Bảng 8 và
Hình 4.
- xem Bảng 8

Đối với bệnh nhân có khối u biểu hiện PD-L1 dương tính, tỷ lệ sống không tái phát bệnh lúc 6 tháng là 84% ở nhóm dùng KEYTRUDA và 75% ở nhóm dùng giả dược (Tỷ số nguy cơ là 0,54 (khoảng tin cậy 95%: 0,42, 0,69); p < 0,0001). Ngoài ra, các phân tích ở các phân nhóm được xác định trước được thực hiện ở những bệnh nhân có khối u PD-L1 âm tính, đột biến BRAF dương tính hoặc âm tính. Lợi ích về thời gian sống không tái phát bệnh đối với KEYTRUDA so với giả dược đã được quan sát thấy bất kể biểu hiện PD-L1 của khối u hoặc tình trạng đột biến BRAF. Tỷ số nguy cơ của thời gian sống còn không tái phát bệnh (RFS HR) đối với KEYTRUDA là 0,47 (khoảng tin cậy 95%: 0,26, 0,85) đối với bệnh nhân có khối u PD-L1 âm tính. RFS HR là 0,49 (khoảng tin cậy 95%: 0,36, 0,67) đối với bệnh nhân có khối u với đột biến BRAF dương tính và 0,64 (khoảng tin cậy 95%: 0,47, 0,87) đối với bệnh nhân có khối u với đột biến BRAF âm tính.
- xem Hình 4
 UNG THƯ PHỔI KHÔNG TẾ BÀO NHỎ (NSCLC)
UNG THƯ PHỔI KHÔNG TẾ BÀO NHỎ (NSCLC)
Điều trị bước 1 ung thư phổi không tế bào nhỏ (NSCLC)
KEYNOTE-189: Thử nghiệm có đối chứng về liệu pháp phối hợp ở bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC), không phải tế bào vảy, chưa từng điều trị
Hiệu quả của KEYTRUDA phối hợp với hóa trị liệu có chứa pemetrexed và platin đã được nghiên cứu trong một thử nghiệm đa trung tâm, ngẫu nhiên, đối chứng với hoạt chất, mù đôi, KEYNOTE-189. Tiêu chuẩn đủ điều kiện chính là ung thư phổi không tế bào nhỏ, không phải tế bào vảy, di căn, không có điều trị toàn thân trước đó đối với ung thư phổi không tế bào nhỏ di căn và không có sai lệch EGFR hoặc ALK trong hệ gen khối u. Những bệnh nhân bị bệnh tự miễn đòi hỏi liệu pháp toàn thân trong 2 năm điều trị; một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch; hoặc những người đã được xạ trị ở ngực hơn 30 Gy trong vòng 26 tuần trước đó là không đủ điều kiện. Các bệnh nhân được phân ngẫu nhiên (2:1) để dùng một trong các phác đồ sau:
• KEYTRUDA 200 mg với pemetrexed 500 mg/m
2 và lựa chọn của nhà nghiên cứu về cisplatin 75 mg/m
2 hoặc carboplatin AUC 5 mg/mL/phút tiêm truyền tĩnh mạch mỗi 3 tuần trong 4 chu kỳ, sau đó là KEYTRUDA 200 mg và pemetrexed 500 mg/m
2 tiêm truyền tĩnh mạch mỗi 3 tuần.
• Giả dược với pemetrexed 500 mg/m
2 và lựa chọn của nhà nghiên cứu về cisplatin 75 mg/m
2 hoặc carboplatin AUC 5 mg/mL/phút tiêm truyền tĩnh mạch mỗi 3 tuần trong 4 chu kỳ, sau đó là giả dược và pemetrexed 500 mg/m
2 tiêm truyền tĩnh mạch mỗi 3 tuần.
Tiếp tục điều trị bằng KEYTRUDA cho đến khi tiến triển bệnh được xác định theo tiêu chuẩn đánh giá đáp ứng về khối u đặc (RECIST) 1.1 như được xác định bởi nhà nghiên cứu, độc tính không thể chấp nhận được, hoặc tối đa 24 tháng. Việc sử dụng KEYTRUDA được cho phép sau khi tiến triển bệnh được xác định theo RECIST bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR) hoặc sau khi ngừng điều trị bằng pemetrexed nếu bệnh nhân ổn định trên lâm sàng và có lợi ích lâm sàng như được xác định bởi nhà nghiên cứu. Đối với những bệnh nhân đã hoàn thành 24 tháng điều trị hoặc có đáp ứng hoàn toàn, có thể bắt đầu lại việc điều trị bằng KEYTRUDA đối với tiến triển bệnh và được điều trị thêm đến 1 năm. Đánh giá tình trạng khối u được thực hiện vào tuần thứ 6 và tuần thứ 12, sau đó mỗi 9 tuần. Những bệnh nhân đang dùng giả dược cộng với hóa trị liệu có tiến triển bệnh đã được xác nhận bằng xem xét độc lập được dùng KEYTRUDA dưới dạng đơn trị liệu.
Trong số 616 bệnh nhân trong nghiên cứu KEYNOTE-189 (410 bệnh nhân ở nhóm dùng phối hợp KEYTRUDA và 206 bệnh nhân ở nhóm dùng giả dược cộng với hóa trị liệu), các đặc điểm ban đầu là: tuổi trung vị là 64 tuổi (49% từ 65 tuổi trở lên); 59% là nam giới; 94% là người da trắng và 3% là người châu Á; điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG theo thứ tự là 0 hoặc 1 ở 43% và 56% bệnh nhân; 31% bệnh nhân có PD-L1 TPS < 1% và 18% bệnh nhân bị di căn não đã được điều trị hoặc chưa được điều trị lúc ban đầu. Tổng cộng có 67 bệnh nhân ở nhóm dùng giả dược cộng với hóa trị liệu đã được bắt chéo dùng đơn trị liệu bằng KEYTRUDA tại thời điểm tiến triển bệnh và 18 bệnh nhân bổ sung đã dùng thuốc ức chế điểm kiểm soát (checkpoint) như là điều trị tiếp theo.
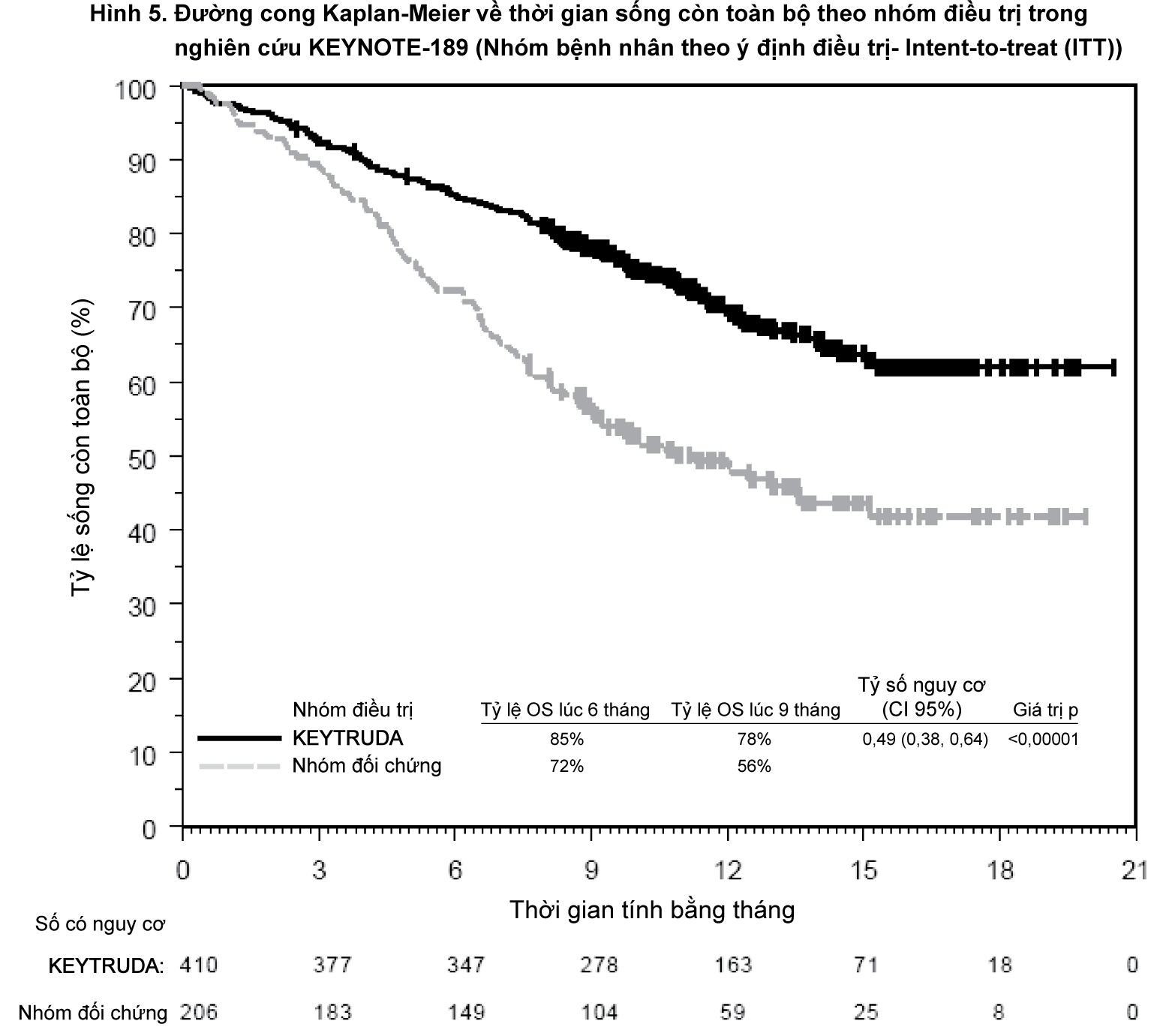
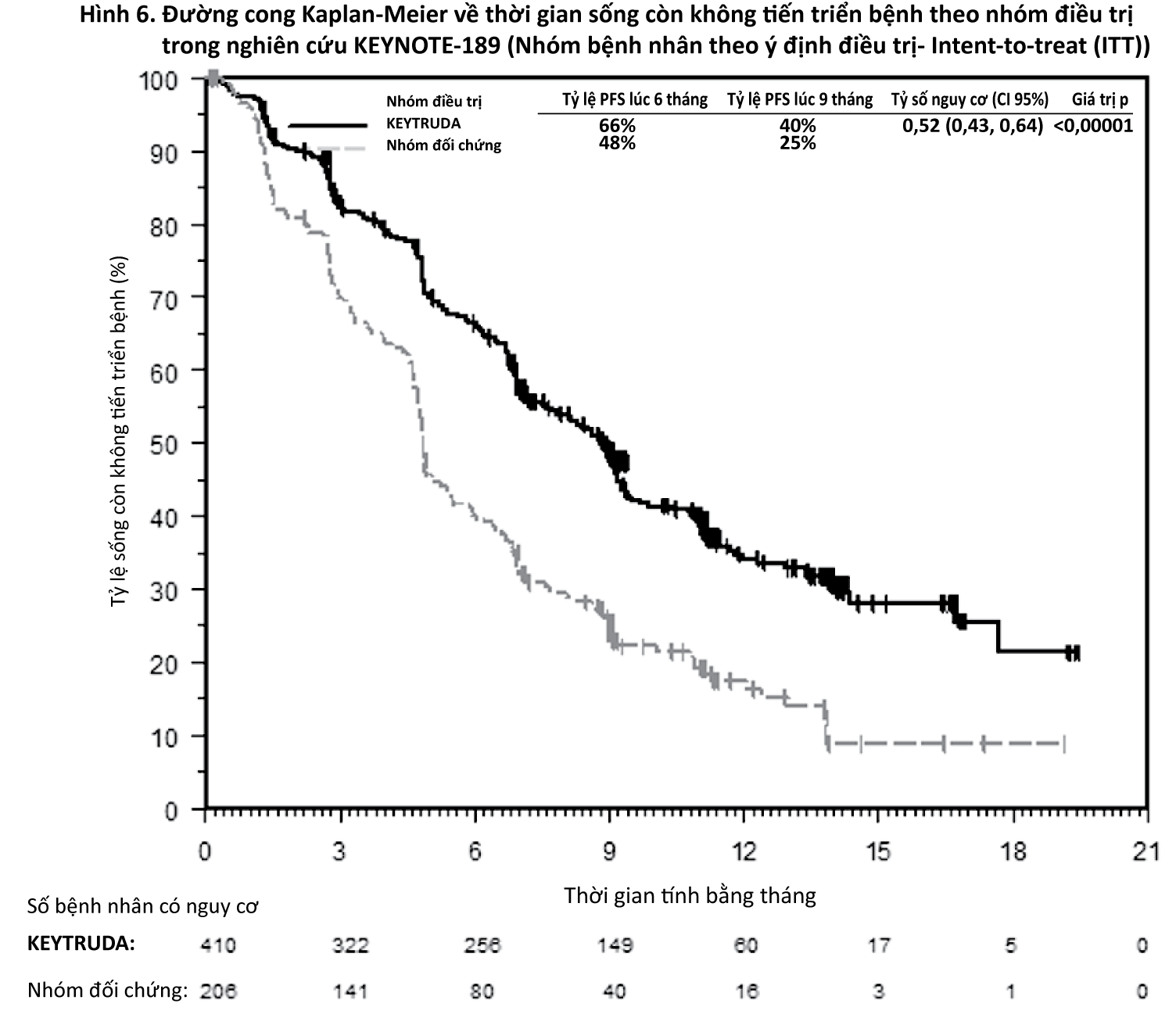
Đánh giá kết quả chính về hiệu quả là thời gian sống còn toàn bộ (OS) và thời gian sống còn không tiến triển bệnh (PFS) (như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR) sử dụng tiêu chuẩn đánh giá đáp ứng về khối u đặc [RECIST], phiên bản 1.1). Đánh giá kết quả về hiệu quả bổ sung là tỷ lệ đáp ứng toàn bộ (ORR) và thời gian đáp ứng, theo đánh giá của BICR sử dụng RECIST 1.1. Thời gian theo dõi trung vị là 10,5 tháng (khoảng từ 0,2 - 20,4 tháng).
Bảng 9 tóm tắt các đánh giá về hiệu quả chính.
- xem Bảng 9

- xem Hình 5 và 6
Kết quả do bệnh nhân báo cáo đã được đánh giá, sử dụng EORTC QLQ-C30 và EORTC QLQ-LC13 (Bảng câu hỏi đánh giá chất lượng cuộc sống của bệnh nhân ung thư của Tổ chức Nghiên cứu và điều trị ung thư châu Âu). Các phân tích thăm dò những bệnh nhân sử dụng liệu pháp phối hợp pembrolizumab đã cho thấy tình trạng sức khỏe chung/Chất lượng cuộc sống theo EORTC QLQ-C30 ổn định ở tuần thứ 12 và tuần thứ 21 so với suy giảm ở bệnh nhân dùng giả dược cộng với hóa trị liệu. Có một xu hướng kéo dài thời gian cho đến khi tình trạng xấu đi theo tiêu chí của EORTC QLQ-LC13/QLQ-C30 về ho, khó thở hoặc đau ngực đã được quan sát thấy đối với bệnh nhân dùng liệu pháp phối hợp với pembrolizumab.
KEYNOTE-407: Thử nghiệm có đối chứng về liệu pháp phối hợp ở bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC), loại tế bào vảy, chưa từng điều trị
Hiệu quả của KEYTRUDA phối hợp với carboplatin và paclitaxel hoặc nab-paclitaxel đã được khảo sát trong nghiên cứu KEYNOTE-407, một nghiên cứu ngẫu nhiên, mù đôi, đa trung tâm, đối chứng với giả dược. Tiêu chuẩn đủ điều kiện chính của nghiên cứu này là ung thư phổi không tế bào nhỏ, loại tế bào vảy, di căn, bất kể tình trạng biểu hiện PD-L1 của khối u và không có điều trị toàn thân trước đó đối với bệnh di căn. Những bệnh nhân bị bệnh tự miễn đòi hỏi liệu pháp toàn thân trong 2 năm điều trị; một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch; hoặc những người đã được xạ trị ở ngực hơn 30 Gy trong vòng 26 tuần trước đó là không đủ điều kiện. Việc chọn ngẫu nhiên được phân tầng theo biểu hiện PD-L1 của khối u (TPS < 1% [âm tính] so với TPS ≥ 1%), lựa chọn của nhà nghiên cứu về paclitaxel hoặc nab-paclitaxel và theo vùng địa lý (Đông Á so với không thuộc Đông Á). Các bệnh nhân được phân ngẫu nhiên (1:1) vào một trong các nhóm điều trị sau; tất cả các thuốc nghiên cứu được dùng qua tiêm truyền tĩnh mạch. KEYTRUDA 200 mg và carboplatin AUC 6 mg/mL/phút vào ngày thứ 1 của mỗi chu kỳ 21 ngày trong 4 chu kỳ, và paclitaxel 200 mg/m
2 vào ngày thứ 1 của mỗi chu kỳ 21 ngày trong 4 chu kỳ hoặc nab-paclitaxel 100 mg/m
2 vào ngày thứ 1, 8 và 15 của mỗi chu kỳ 21 ngày trong 4 chu kỳ, tiếp theo là KEYTRUDA 200 mg mỗi 3 tuần. KEYTRUDA đã được dùng trước khi hóa trị liệu vào ngày thứ 1.
Giả dược và carboplatin AUC 6 mg/mL/phút vào ngày thứ 1 của mỗi chu kỳ 21 ngày trong 4 chu kỳ và paclitaxel 200 mg/m
2 vào ngày thứ 1 của mỗi chu kỳ 21 ngày trong 4 chu kỳ hoặc nab-paclitaxel 100 mg/m
2 vào ngày thứ 1, 8 và 15 của mỗi chu kỳ 21 ngày trong 4 chu kỳ, tiếp theo là giả dược mỗi 3 tuần.
Tiếp tục điều trị bằng KEYTRUDA hoặc giả dược cho đến khi tiến triển bệnh được xác định theo tiêu chuẩn đánh giá đáp ứng về khối u đặc (RECIST) 1.1 như được xác định bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR), độc tính không thể chấp nhận được, hoặc tối đa 24 tháng. Việc sử dụng KEYTRUDA được cho phép sau khi tiến triển bệnh được xác định theo RECIST nếu bệnh nhân ổn định trên lâm sàng và có lợi ích lâm sàng như được xác định bởi nhà nghiên cứu. Có thể bắt đầu lại việc điều trị bằng KEYTRUDA đối với tiến triển bệnh sau đó và được điều trị thêm cho đến 1 năm.
Những bệnh nhân ở nhóm giả dược được cho dùng KEYTRUDA như một thuốc duy nhất tại thời điểm tiến triển bệnh.
Đánh giá tình trạng khối u đã được thực hiện mỗi 6 tuần cho đến tuần thứ 18, mỗi 9 tuần cho đến tuần thứ 45 và mỗi 12 tuần sau đó. Đánh giá kết quả chính về hiệu quả là tỷ lệ sống còn không tiến triển bệnh và tỷ lệ đáp ứng khách quan (ORR) như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR) sử dụng tiêu chuẩn đánh giá đáp ứng về khối u đặc (RECIST) 1.1 và thời gian sống còn toàn bộ. Đánh giá kết quả về hiệu quả bổ sung là thời gian đáp ứng như được đánh giá bởi BICR, sử dụng RECIST 1.1.
Tổng cộng có 559 bệnh nhân được phân ngẫu nhiên: 278 bệnh nhân vào nhóm dùng KEYTRUDA và 281 bệnh nhân vào nhóm dùng giả dược. Các đặc điểm của nhóm bệnh nhân nghiên cứu là: tuổi trung vị là 65 tuổi (khoảng từ 29-88); 55% từ 65 tuổi trở lên; 81% là nam giới; 77% là người da trắng; điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 (29%) và 1 (71%) và 8% bệnh nhân bị di căn não đã được điều trị hoặc chưa được điều trị lúc ban đầu. Ba mươi lăm phần trăm (35%) bệnh nhân có biểu hiện PD-L1 của khối u TPS < 1% [âm tính]; 19% bệnh nhân từ vùng Đông Á và 60% bệnh nhân dùng paclitaxel.
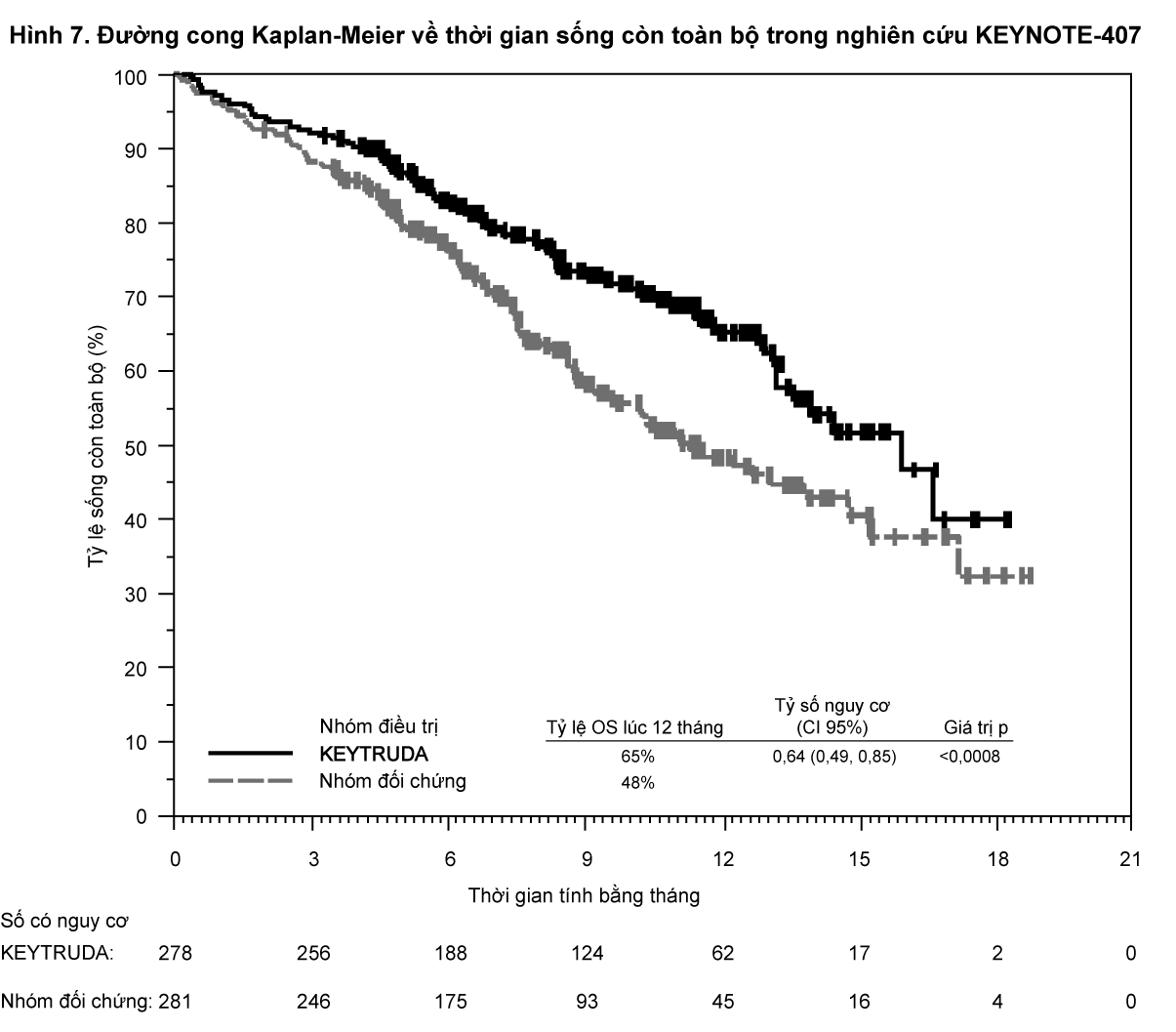
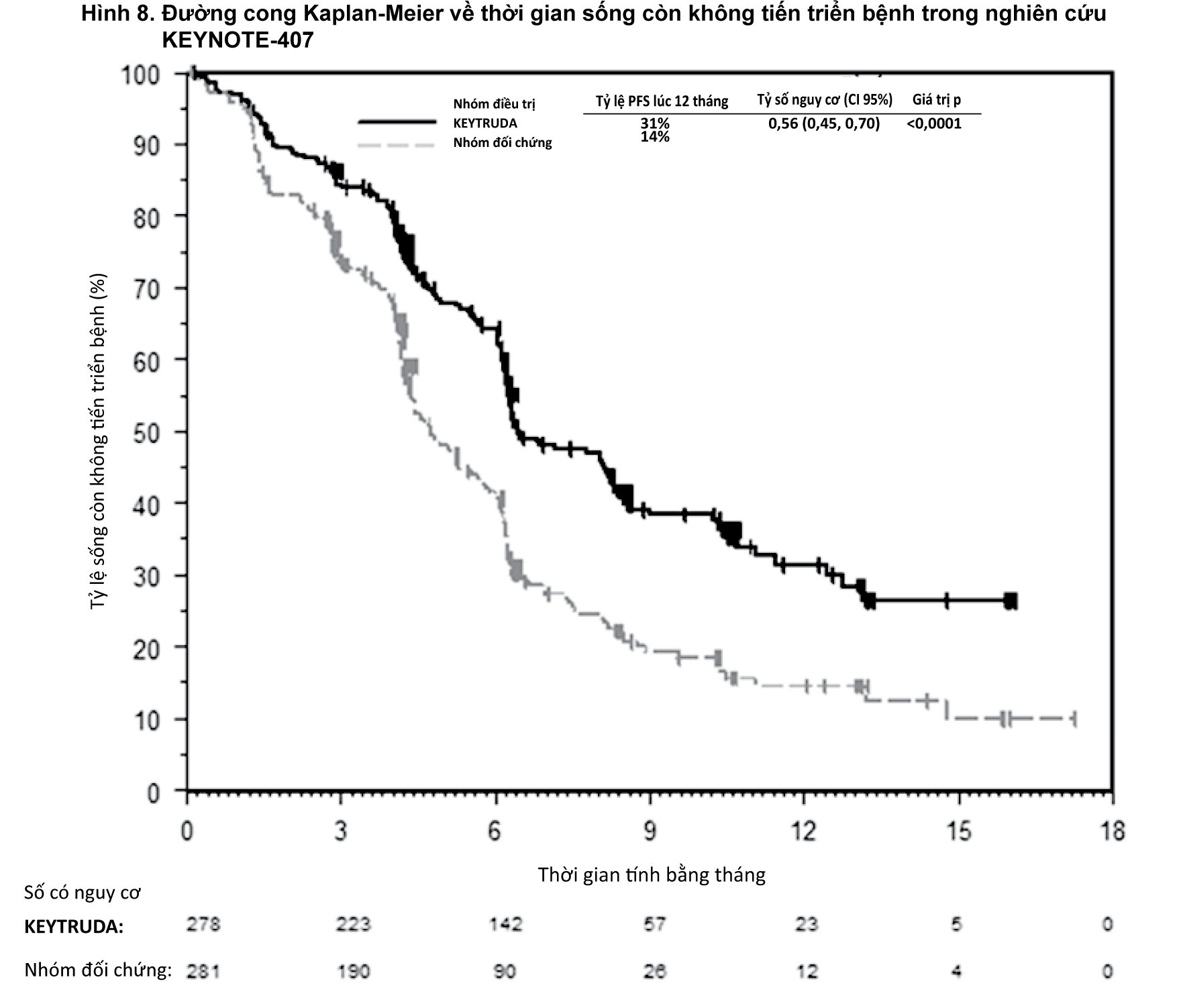
Trong nghiên cứu KEYNOTE-407, có sự cải thiện có ý nghĩa thống kê về thời gian sống còn toàn bộ (OS), thời gian sống còn không tiến triển bệnh (PFS) và tỷ lệ đáp ứng toàn bộ (ORR) ở những bệnh nhân được phân ngẫu nhiên vào nhóm dùng KEYTRUDA phối hợp với carboplatin và paclitaxel hoặc nab-paclitaxel so với những bệnh nhân được phân ngẫu nhiên vào nhóm dùng giả dược cùng với carboplatin và paclitaxel hoặc nab-paclitaxel (xem
Bảng 10 và
Hình 7 và 8).
- xem Bảng 10
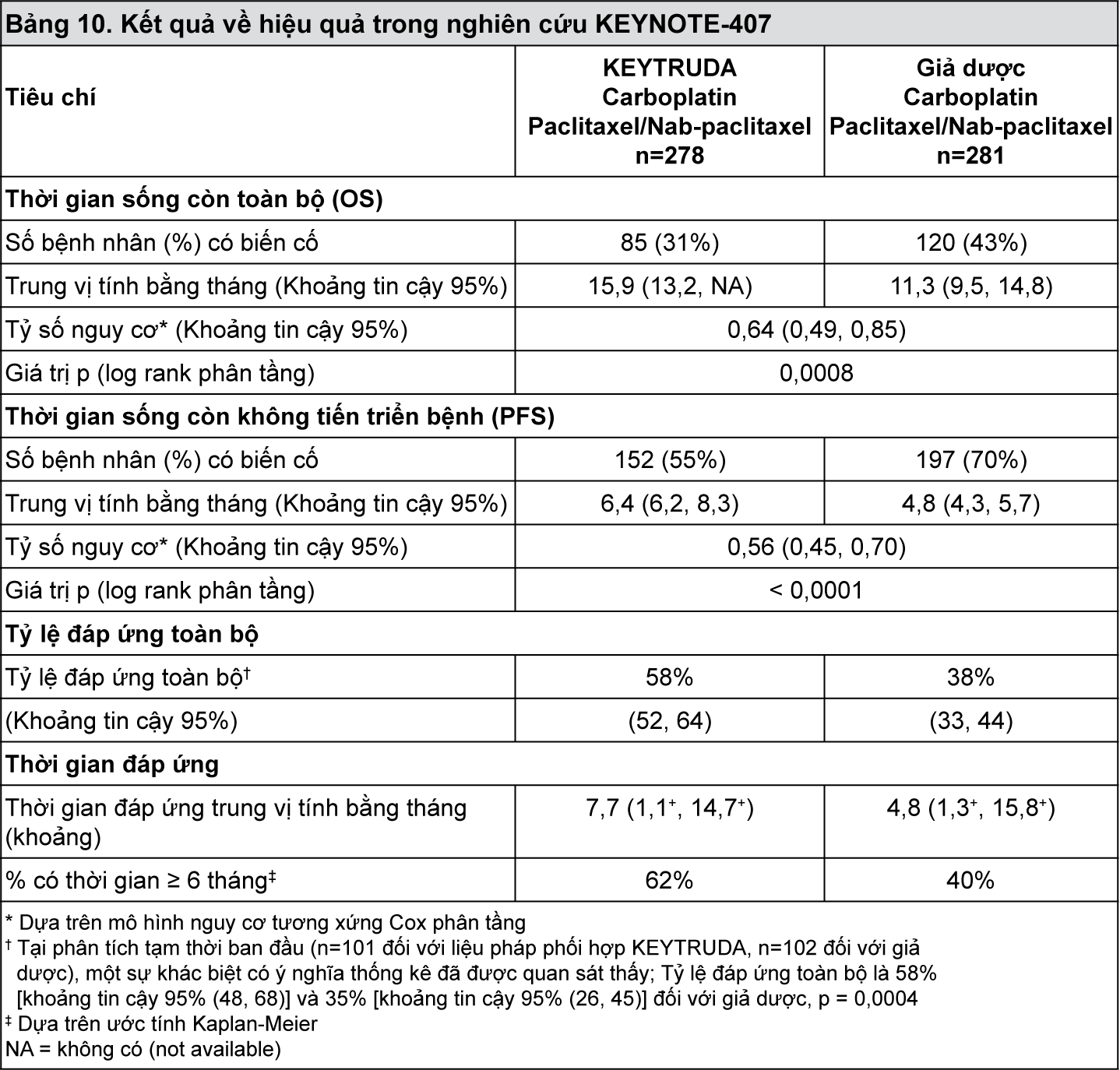
- xem Hình 7 và 8
 KEYNOTE-042: Thử nghiệm có đối chứng ở bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) chưa từng điều trị
KEYNOTE-042: Thử nghiệm có đối chứng ở bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) chưa từng điều trị
Hiệu quả của KEYTRUDA đã được khảo sát trong nghiên cứu KEYNOTE-042 là một thử nghiệm đa trung tâm, ngẫu nhiên, có đối chứng, được tiến hành ở 1.274 bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn III không phải là đối tượng cho phẫu thuật cắt bỏ hoặc hóa-xạ trị triệt căn, hoặc bệnh nhân ung thư phổi không tế bào nhỏ di căn. Chỉ những bệnh nhân có khối u biểu hiện PD-L1 (TPS ≥ 1%) bằng xét nghiệm hóa mô miễn dịch sử dụng PD-L1 IHC 22C3 pharmDx
TM Kit và chưa được điều trị toàn thân trước đó đối với ung thư phổi không tế bào nhỏ di căn là đủ điều kiện. Những bệnh nhân có sai lệch EGFR hoặc ALK trong hệ gen khối u; bệnh tự miễn đòi hỏi trị liệu toàn thân trong vòng 2 năm điều trị; một tình trạng y khoa đòi hỏi phải điều trị bằng liệu pháp ức chế miễn dịch; hoặc những người đã được xạ trị ở vùng lồng ngực hơn 30 Gy trong vòng 26 tuần trước khi phân nhóm là không đủ điều kiện. Các bệnh nhân được phân nhóm ngẫu nhiên (1:1) dùng KEYTRUDA 200 mg mỗi 3 tuần (n=637) hoặc hóa trị liệu có chứa platin theo lựa chọn của nhà nghiên cứu (n=637; bao gồm pemetrexed+carboplatin hoặc paclitaxel+carboplatin. Các bệnh nhân ung thư phổi không tế bào nhỏ không phải tế bào vảy có thể điều trị duy trì bằng pemetrexed). Các bệnh nhân được điều trị bằng KEYTRUDA cho đến khi độc tính không thể chấp nhận được hoặc tiến triển bệnh. Có thể tiếp tục điều trị sau khi tiến triển bệnh nếu bệnh nhân có lâm sàng ổn định và được cho là nhận được lợi ích lâm sàng theo đánh giá của nhà nghiên cứu. Những bệnh nhân không có tiến triển bệnh có thể được điều trị cho đến 24 tháng. Có thể bắt đầu lại việc điều trị bằng KEYTRUDA đối với tiến triển bệnh sau khi đã ngừng tại thời điểm 24 tháng như liệu pháp ở bước tiếp theo và được sử dụng thêm đến 1 năm. Đánh giá tình trạng khối u được thực hiện mỗi 9 tuần.
Trong số 1.274 bệnh nhân trong nghiên cứu KEYNOTE-042, các đặc điểm ban đầu là: tuổi trung vị là 63 tuổi (45% từ 65 tuổi trở lên); 71% là nam giới; 64% là người da trắng và 30% là người châu Á: 19% là người Tây Ban Nha hoặc Bồ Đào Nha hoặc người La-tinh; và 31% và 69% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG theo thứ tự là 0 và 1. Đặc điểm bệnh là tế bào vảy (39%) và không tế bào vảy (61%); M0 (13%), M1 (87%); và di căn não được điều trị (6%). 47% bệnh nhân có TPS ≥ 50% và 53% có TPS từ 1 đến 49%.
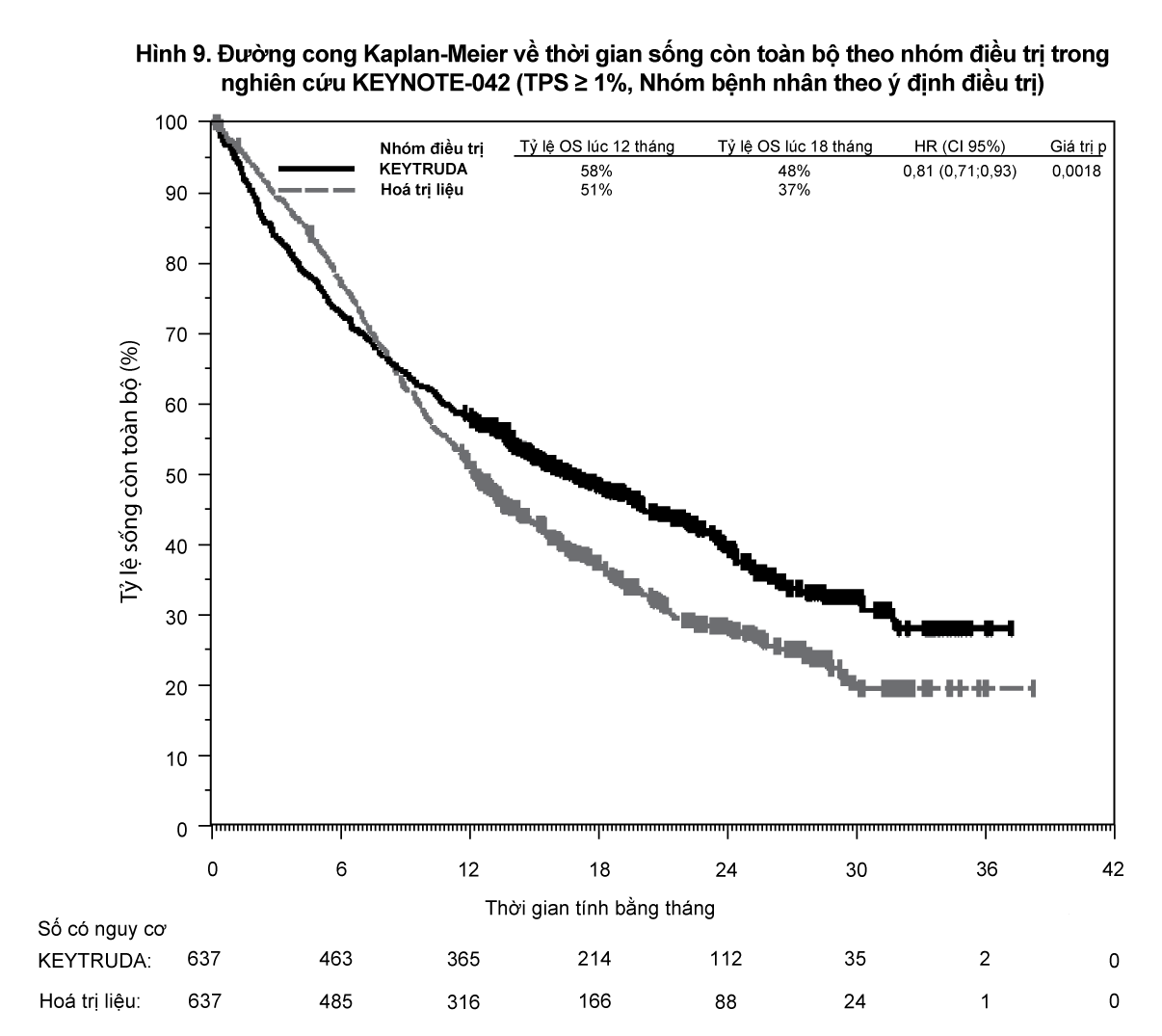
Đánh giá kết cục chính về hiệu quả là thời gian sống còn toàn bộ (OS). Đánh giá kết cục phụ về hiệu quả là thời gian sống còn không tiến triển bệnh (PFS) và tỷ lệ đáp ứng toàn bộ (ORR) được đánh giá bởi Ủy ban trung tâm đánh giá độc lập, mù với phân bổ điều trị (BICR) sử dụng tiêu chuẩn đánh giá đáp ứng về khối u đặc (RECIST) 1.1.
Bảng 11 tóm tắt các đánh giá về hiệu quả chính đối với toàn bộ nhóm bệnh nhân theo ý định điều trị (ITT) (TPS ≥ 1%).
- xem Bảng 11

- xem Hình 9
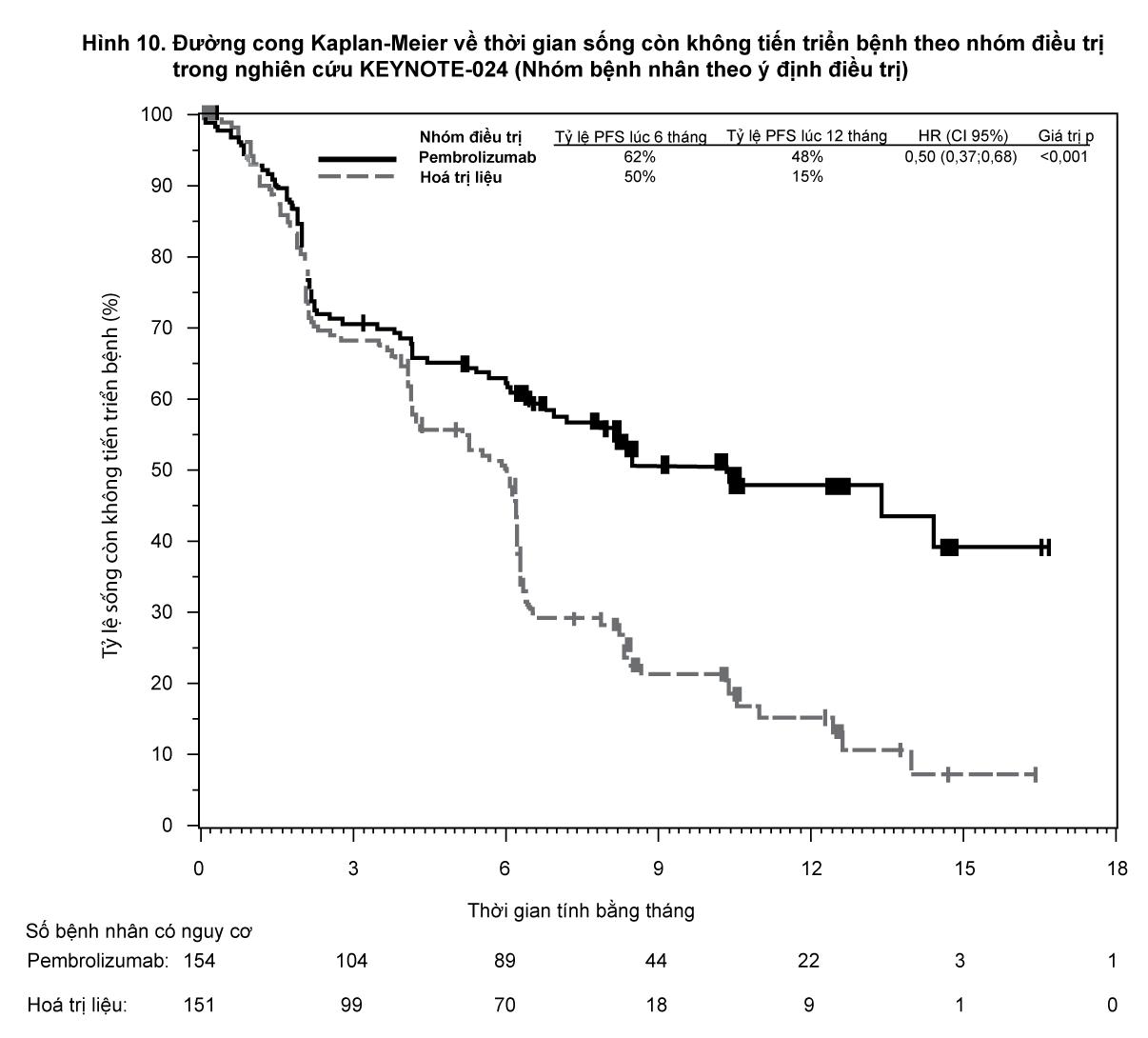
 KEYNOTE-024: Thử nghiệm có đối chứng ở bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) chưa từng điều trị
KEYNOTE-024: Thử nghiệm có đối chứng ở bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) chưa từng điều trị
Độ an toàn và hiệu quả của pembrolizumab đã được khảo sát trong nghiên cứu đa trung tâm có đối chứng KEYNOTE-024 trong điều trị ung thư phổi không tế bào nhỏ (NSCLC) di căn chưa được điều trị trước đây. Thiết kế nghiên cứu tương tự như KEYNOTE-042, ngoại trừ chỉ những bệnh nhân có khối u biểu hiện PD-L1 dương tính với TPS ≥ 50% dựa trên PD-L1 IHC 22C3 pharmDx
TM Kit là đủ điều kiện. Các bệnh nhân được chọn và phân nhóm ngẫu nhiên (1:1) để dùng pembrolizumab ở liều 200 mg mỗi 3 tuần (n=154) hoặc hóa trị liệu có chứa platin theo lựa chọn của nhà nghiên cứu (n=151; bao gồm pemetrexed+carboplatin, pemetrexed+cisplatin, gemcitabin+cisplatin, gemcitabin+carboplatin, hoặc paclitaxel+carboplatin. Các bệnh nhân ung thư phổi không tế bào nhỏ không phải tế bào vảy có thể điều trị duy trì bằng pemetrexed). Những bệnh nhân đang dùng hóa trị liệu có xác định tiến triển bệnh đã được xem xét độc lập có thể bắt chéo và dùng pembrolizumab.
Trong số 305 bệnh nhân trong nghiên cứu KEYNOTE-024, các đặc điểm ban đầu là: tuổi trung vị là 65 tuổi (54% từ 65 tuổi trở lên); 61% là nam giới; 82% là người da trắng, 15% là người châu Á và điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG theo thứ tự là 0 và 1 ở 35% và 65% bệnh nhân. Các đặc điểm của bệnh là tế bào vảy (18%), không phải tế bào vảy (82%); M1 (99%) và di căn não (9%).
Đánh giá kết quả về hiệu quả chính là thời gian sống còn không tiến triển bệnh (PFS) như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR) sử dụng tiêu chuẩn đánh giá đáp ứng về khối u đặc [RECIST], phiên bản 1.1. Đánh giá kết quả về hiệu quả phụ là thời gian sống còn toàn bộ (OS) và tỷ lệ đáp ứng toàn bộ (ORR) (theo đánh giá của BICR sử dụng RECIST 1.1).
Bảng 12 tóm tắt các đánh giá về hiệu quả chính đối với toàn bộ nhóm theo ý định nghiên cứu (ITT).
- xem Bảng 12
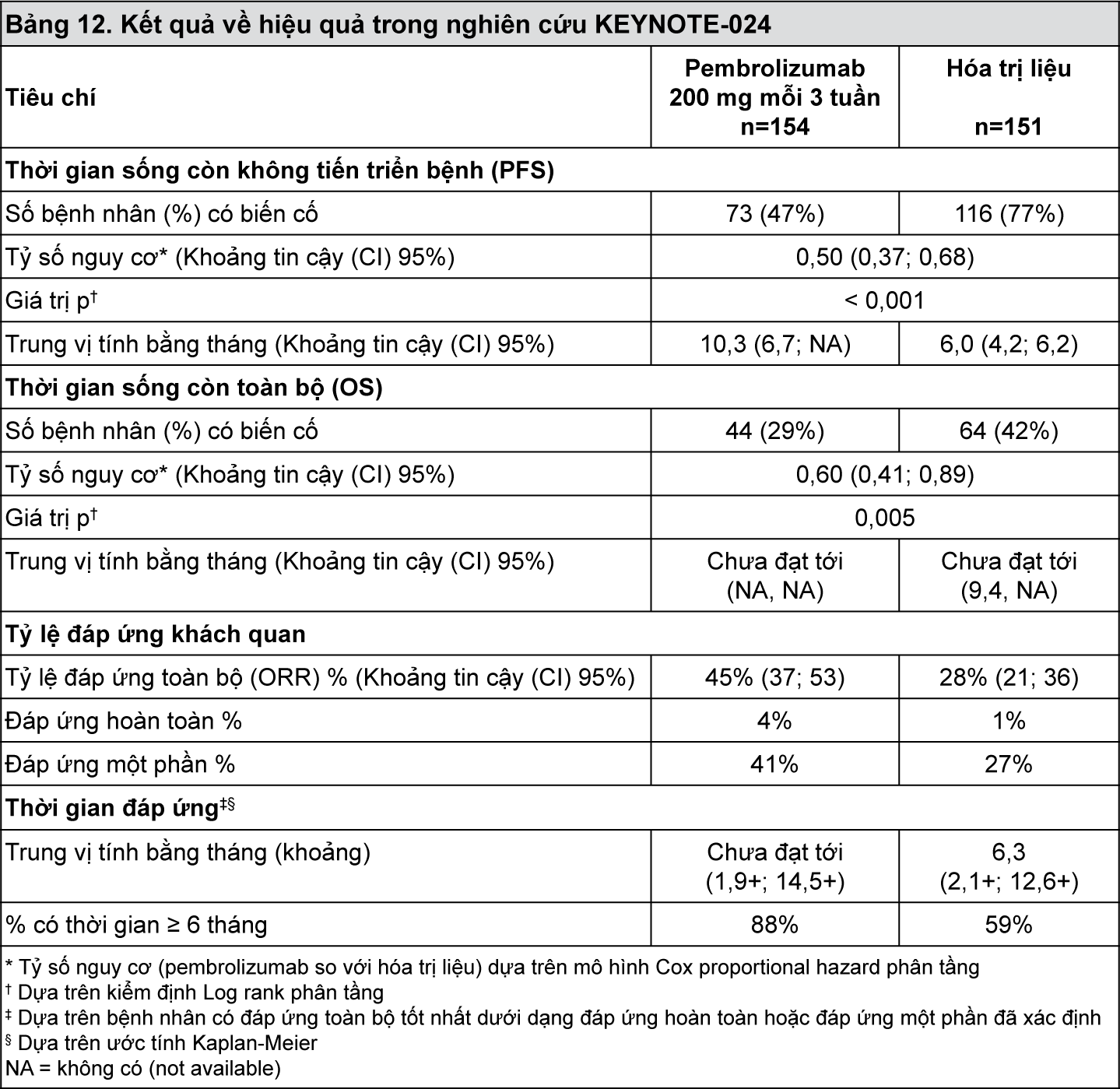
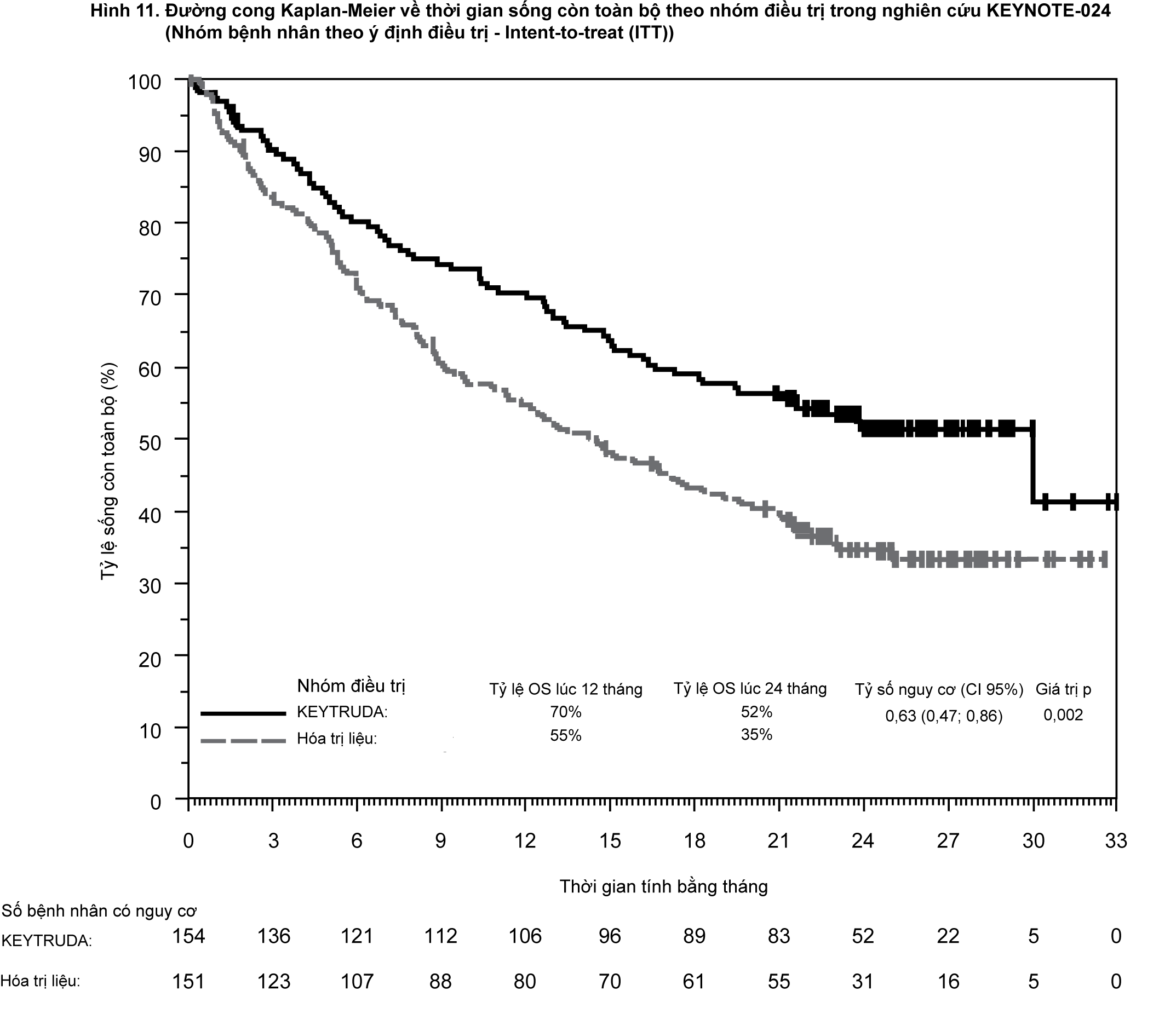
Phân tích thời gian sống còn toàn bộ (OS) cuối cùng được đánh giá dựa trên theo dõi trung bình 25 tháng ở 169 bệnh nhân (73 bệnh nhân dùng Keytruda và 96 bệnh nhân dùng hóa trị liệu). Thời gian sống còn toàn bộ (OS) trung bình là 30 tháng (khoảng tin cậy CI 95%: 18,3; NA) cho nhóm dùng Keytruda và 14,2 tháng (khoảng tin cậy CI 95%: 9,8; 19,0) cho nhóm dùng hóa trị liệu. Tỉ số nguy cơ (HR) của thời gian sống còn toàn bộ (OS) là 0,63 (khoảng tin cậy CI 95%: 0,47; 0,86; p=0,002).
- xem Hình 10 và 11
Trong một phân tích phân nhóm, đã quan sát thấy giảm lợi ích sống còn của pembrolizumab so với hóa trị liệu ở một số nhỏ bệnh nhân là những người không bao giờ hút thuốc lá; tuy nhiên, do số lượng nhỏ bệnh nhân, nên không có kết luận dứt khoát nào có thể được rút ra từ những dữ liệu này.
Ung thư phổi không tế bào nhỏ (NSCLC) đã được điều trị trước đó
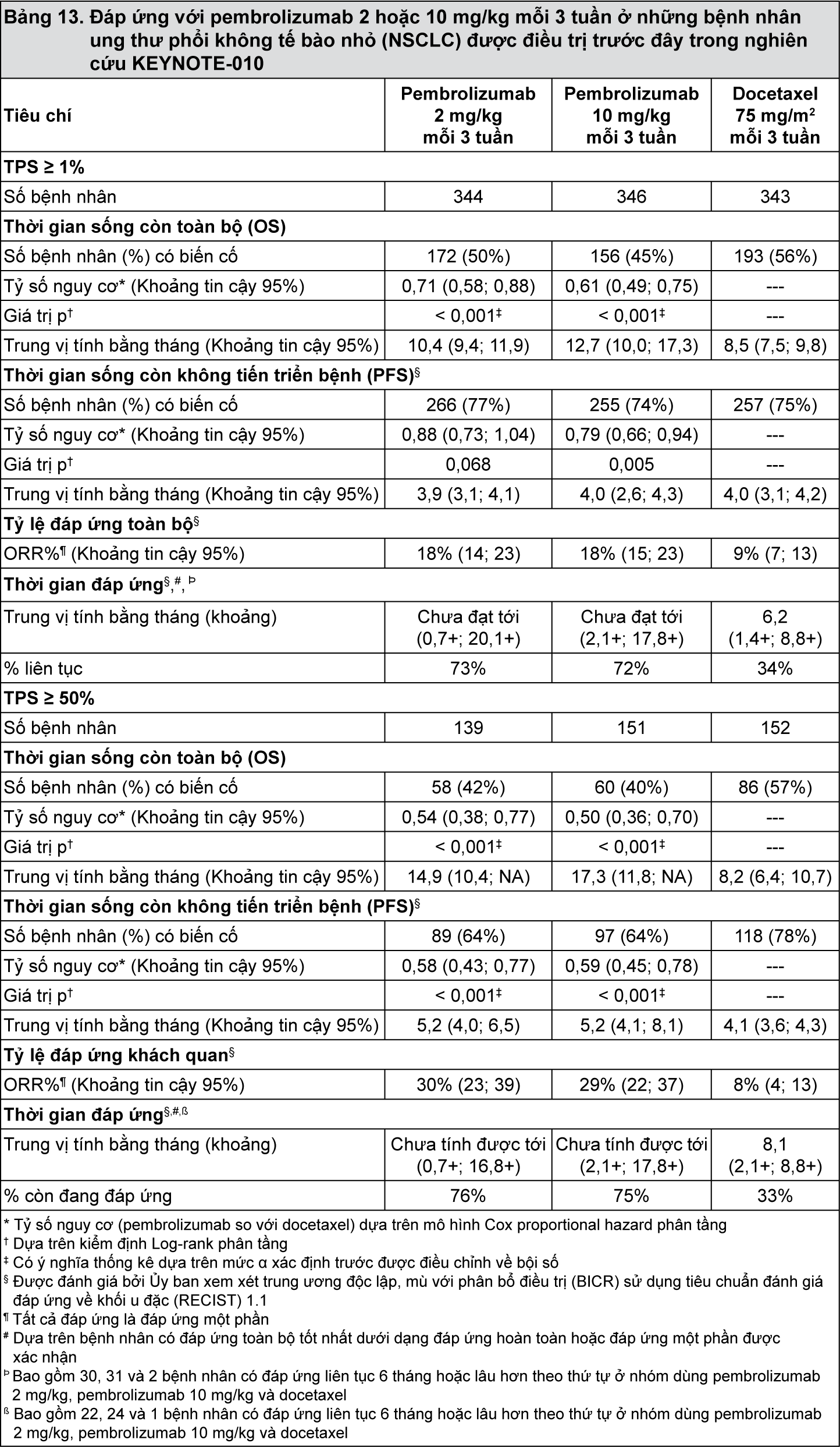
KEYNOTE-010: Thử nghiệm có đối chứng ở bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) đã điều trị trước đây bằng hóa trị liệu
Độ an toàn và hiệu quả của pembrolizumab đã được khảo sát trong nghiên cứu KEYNOTE-010, một nghiên cứu đa trung tâm, nhãn mở, có đối chứng trong điều trị ung thư phổi không tế bào nhỏ tiến triển ở bệnh nhân đã điều trị trước đây bằng hóa trị liệu có chứa platin. Các bệnh nhân đã có biểu hiện PD-L1 với TPS ≥ 1% dựa trên PD-L1 IHC 22C3 pharmDx
TM Kit. Các bệnh nhân có đột biến hoạt hóa EGFR hoặc chuyển vị ALK cũng có sự tiến triển bệnh khi đang dùng liệu pháp đã được phê duyệt đối với những đột biến này trước khi dùng pembrolizumab. Các bệnh nhân được chọn ngẫu nhiên (1:1:1) để dùng pembrolizumab ở liều 2 mg/kg (n=344) hoặc 10 mg/kg (n=346) mỗi 3 tuần hoặc docetaxel ở liều 75 mg/m
2 mỗi 3 tuần (n=343) cho đến khi tiến triển bệnh hoặc độc tính không thể chấp nhận được. Thử nghiệm đã loại trừ những bệnh nhân bị bệnh tự miễn; một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch; hoặc những người đã được xạ trị ở ngực hơn 30 Gy trong vòng 26 tuần trước đó. Đánh giá tình trạng khối u đã được thực hiện mỗi 9 tuần.
Các đặc điểm ban đầu đối với nhóm bệnh nhân này gồm: tuổi trung vị là 63 tuổi (42% từ 65 tuổi trở lên); 61% là nam giới; 72% là người da trắng, 21% là người châu Á và điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG theo thứ tự là 0 và 1 ở 34% và 66% bệnh nhân. Các đặc điểm của bệnh là tế bào vảy (21%), không phải tế bào vảy (70%), M1 (91%), di căn não ổn định (15%) và tỷ lệ đột biến là EGFR (8%) hoặc ALK (1%). Điều trị trước đó bao gồm phác đồ 2 thuốc có chứa platin (100%); các bệnh nhân nhận được một bước điều trị (69%) hoặc hai bước điều trị hay nhiều hơn (29%).
Đánh giá kết quả về hiệu quả chính là thời gian sống còn toàn bộ (OS) và thời gian sống còn không tiến triển bệnh (PFS) như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR) sử dụng tiêu chuẩn đánh giá đáp ứng về khối u đặc (RECIST) 1.1. Đánh giá kết quả về hiệu quả phụ là tỷ lệ đáp ứng toàn bộ (ORR) và thời gian đáp ứng.
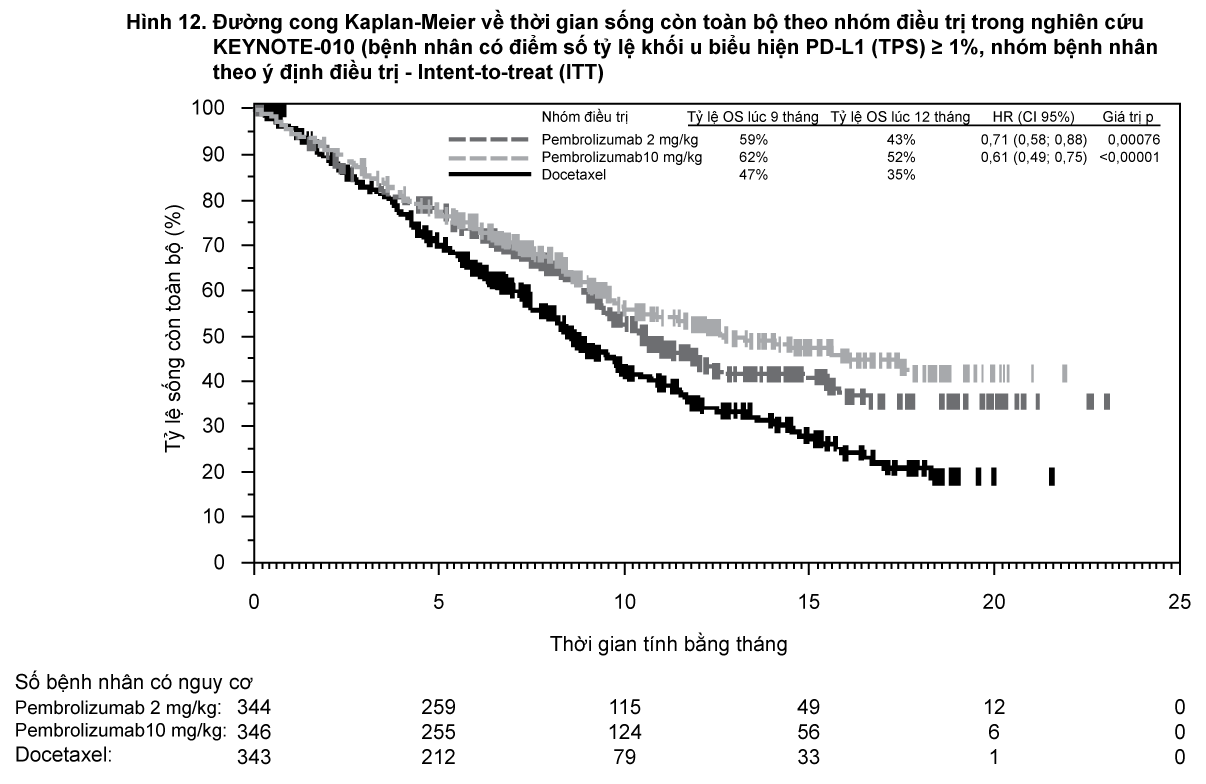
Bảng 11 tóm tắt các đánh giá về hiệu quả chính đối với toàn bộ nhóm nghiên cứu (TPS ≥ 1%) và đối với những bệnh nhân có TPS ≥ 50% và đường cong Kaplan-Meier về thời gian sống còn toàn bộ (OS) (TPS ≥ 1%) được thể hiện trong
Hình 12.
- xem Bảng 13
- xem Hình 12
Kết quả về hiệu quả tương tự đối với các nhóm dùng pembrolizumab 2 mg/kg và 10 mg/kg. Kết quả về hiệu quả đối với thời gian sống còn toàn bộ (OS) là đồng nhất bất kể độ tuổi của mẫu khối u (mẫu mới so với mẫu lưu) dựa trên sự so sánh giữa các nhóm.
Trong các phân tích phân nhóm, đã quan sát thấy giảm lợi ích sống còn của pembrolizumab so với docetaxel đối với những bệnh nhân là những người không bao giờ hút thuốc lá hoặc những bệnh nhân có khối u chứa đột biến hoạt hóa EGFR đã dùng ít nhất là hóa trị liệu có chứa platin và thuốc ức chế tyrosine kinase; tuy nhiên, do số lượng nhỏ bệnh nhân, không có kết luận dứt khoát nào có thể được rút ra từ những dữ liệu này.
Hiệu quả và độ an toàn của pembrolizumab ở những bệnh nhân có khối u mà không có biểu hiện PD-L1 chưa được xác định.
U LYMPHO HODGKIN KINH ĐIỂN
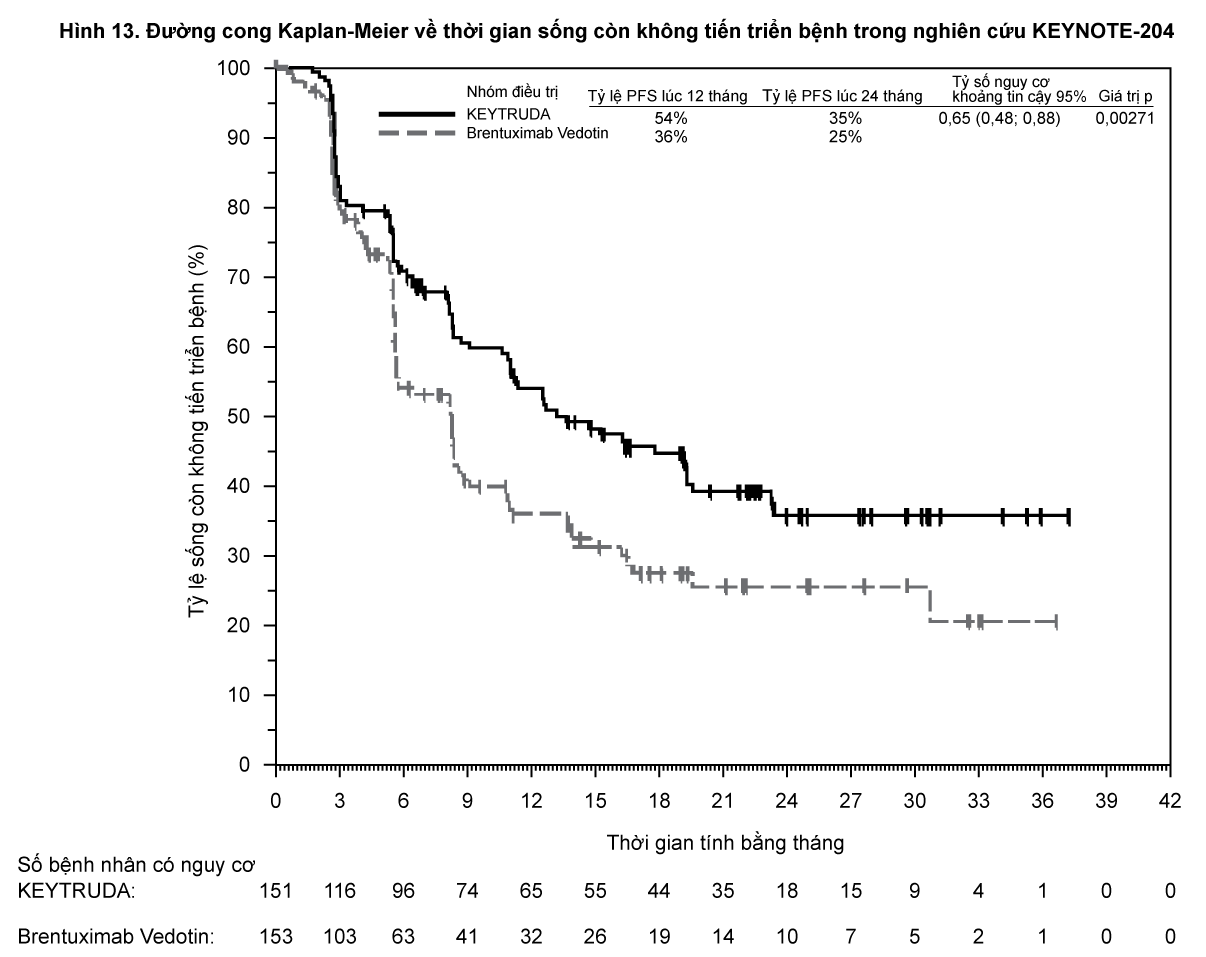
KEYNOTE-204: Nghiên cứu có đối chứng ở bệnh nhân bị u lympho Hodgkin kinh điển (cHL) tái phát hoặc kháng trị
KEYNOTE-204 là một thử nghiệm ngẫu nhiên, nhãn mở, đối chứng với hoạt chất được tiến hành ở 304 bệnh nhân bị u lympho Hodgkin kinh điển tái phát hoặc kháng trị. Những bệnh nhân bị viêm phổi không nhiễm khuẩn hoạt động, đã được ghép tế bào gốc tạo máu (HSCT) cùng loài trong vòng 5 năm qua (hoặc > 5 năm nhưng có triệu chứng của bệnh mảnh ghép chống lại vật chủ (GVHD)), bệnh tự miễn hoạt động, một tình trạng y khoa đòi hỏi điều trị
bằng liệu pháp ức chế miễn dịch, hoặc nhiễm khuẩn hoạt động yêu cầu điều trị toàn thân là không đủ điều kiện tham gia thử nghiệm. Việc chọn ngẫu nhiên được phân tầng theo ghép tế bào gốc tự thân (Auto-SCT) trước đó (Có so với Không) và tình trạng bệnh sau khi điều trị bước đầu (kháng trị nguyên phát so với tái phát dưới 12 tháng sau khi hoàn thành so với tái phát lúc 12 tháng hoặc hơn sau khi hoàn thành). Các bệnh nhân được chọn phân nhóm ngẫu nhiên (1:1) vào một trong các nhóm điều trị sau:
• KEYTRUDA 200 mg tiêm truyền tĩnh mạch mỗi 3 tuần
• Brentuximab vedotin (BV) 1,8 mg/kg tiêm truyền tĩnh mạch mỗi 3 tuần
Các bệnh nhân được điều trị bằng KEYTRUDA 200 mg tiêm truyền tĩnh mạch mỗi 3 tuần cho đến khi độc tính không thể chấp nhận được hoặc tiến triển bệnh được xác định nhận. Đánh giá bệnh được thực hiện mỗi 12 tuần. Đánh giá kết cục chính về hiệu quả là thời gian sống còn không tiến triển bệnh (PFS) và tỷ lệ đáp ứng khách quan (ORR) được đánh giá bởi Ủy ban trung tâm đánh giá trung ương độc lập, mù với phân bổ điều trị (BICR) theo tiêu chuẩn sửa đổi năm 2007 của Nhóm công tác quốc tế (IWG).
Trong số những bệnh nhân của nghiên cứu KEYNOTE-204, các đặc điểm ban đầu là: tuổi trung vị là 35 tuổi (16% từ 65 tuổi trở lên); 57% là nam giới; 77% là người da trắng; 61% bệnh nhân có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 và 38% bệnh nhân có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 1. Trung vị số bước điều trị trước đó đã dùng trong điều trị u lympho Hodgkin kinh điển là 2 (khoảng 1-11). 42% bệnh nhân kháng trị với liệu pháp cuối cùng trước đó và 29% bệnh nhân bị bệnh kháng trị nguyên phát. 37% bệnh nhân đã được ghép tế bào gốc tạo máu tự thân trước đó, 5% đã được điều trị bằng brentuximab vedotin (BV) trước đó và 39% đã được xạ trị trước đó.Trung vị thời gian theo dõi đối với 151 bệnh nhân được điều trị bằng KEYTRUDA là 24,9 tháng (khoảng: 1,8-42 tháng). Kết quả về hiệu quả được tóm tắt trong
Bảng 14.
- xem Bảng 14

- xem Hình 13
Kết quả do bệnh nhân báo cáo (PRO) đã được đánh giá, sử dụng bảng EORTC QLQ-C30 (Bảng câu hỏi đánh giá chất lượng cuộc sống của bệnh nhân ung thư của Tổ chức Nghiên cứu và điều trị ung thư châu Âu). Thời gian cho đến khi xuất hiện suy giảm tình trạng sức khỏe chung/chất lượng cuộc sống (QoL) theo EORTC QLQ-C30 đã được quan sát thấy ở những bệnh nhân điều trị bằng pembrolizumab kéo dài hơn so với những bệnh nhân điều trị bằng brentuximab vedotin (BV) (Tỷ số nguy cơ (HR) 0,40; khoảng tin cậy 95%: 0,22-0,74). Sau hơn 24 tuần theo dõi, những bệnh nhân điều trị bằng pembrolizumab có sự cải thiện về tình trạng sức khỏe chung/chất lượng cuộc sống so với những bệnh nhân điều trị bằng brentuximab vedotin đã cho thấy suy giảm (sự khác biệt về giá trị trung bình bình phương tối thiểu (LS) = 8,60; khoảng tin cậy 95%: 3,89, 13,31; giá trị p 2 chiều danh nghĩa = 0,0004). Những kết quả này nên được diễn giải trong bối cảnh của thiết kế nghiên cứu nhãn mở và do đó cần thận trọng.
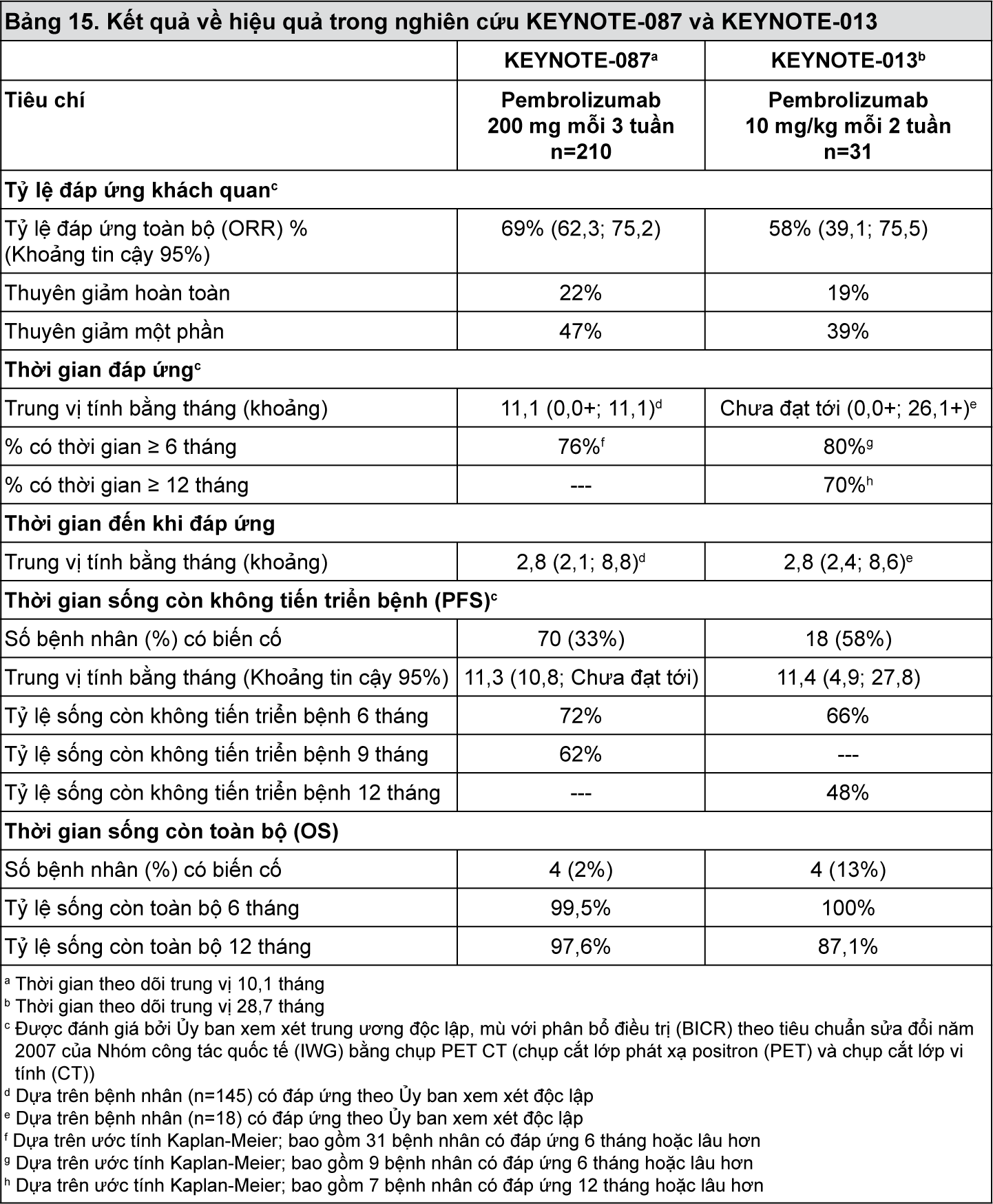
KEYNOTE-087 và KEYNOTE-013: Các nghiên cứu nhãn mở ở bệnh nhân bị u lympho Hodgkin kinh điển (cHL) tái phát hoặc kháng trị
Hiệu quả của pembrolizumab đã được khảo sát trong nghiên cứu KEYNOTE-087 và KEYNOTE-013, 2 nghiên cứu đa trung tâm, nhãn mở trong điều trị 241 bệnh nhân bị u lympho Hodgkin kinh điển. Các nghiên cứu này đã đưa vào những bệnh nhân đã thất bại với ghép tế bào gốc tự thân (ASCT) và với brentuximab vedotin (BV), những người không đủ điều kiện để ghép tế bào gốc tự thân vì họ không thể đạt được sự thuyên giảm bệnh hoàn toàn hoặc một phần với hóa trị liệu cứu nguy và đã thất bại với brentuximab vedotin, hoặc những người đã thất bại với ghép tế bào gốc tự thân và đã không dùng brentuximab vedotin. 5 đối tượng nghiên cứu đã không đủ điều kiện để ghép tế bào gốc tự thân vì những lý do khác ngoài thất bại với hóa trị liệu cứu nguy. Cả hai nghiên cứu đều bao gồm những bệnh nhân bất kể biểu hiện PD-L1. Những bệnh nhân bị viêm phổi hoạt động không do nhiễm trùng, ghép cùng loài trong vòng 5 năm qua (hoặc > 5 năm nhưng có bệnh mảnh ghép chống lại vật chủ (GVHD)), bệnh tự miễn hoạt động hoặc một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch là không đủ điều kiện cho cả hai thử nghiệm. Các bệnh nhân đã dùng pembrolizumab 200 mg mỗi 3 tuần (n=210; KEYNOTE-087) hoặc 10 mg/kg mỗi 2 tuần (n=31; KEYNOTE-013) cho đến khi độc tính không thể chấp nhận được hoặc tiến triển bệnh được ghi nhận.
Trong số những bệnh nhân của nghiên cứu KEYNOTE-087, các đặc điểm ban đầu là: tuổi trung vị là 35 tuổi (9% từ 65 tuổi trở lên); 54% là nam giới; 88% là người da trắng; 49% và 51% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG theo thứ tự là 0 và 1. Số trung vị của các bước điều trị trước đó đã dùng trong điều trị u lympho Hodgkin kinh điển là 4 (khoảng 1-12). 81% bệnh nhân kháng trị với ít nhất 1 dòng điều trị, bao gồm 35% bệnh nhân kháng trị với điều trị bước một. 61% bệnh nhân đã được ghép tế bào gốc tự thân (Auto-SCT), 38% không đủ điều kiện để ghép; 17% không sử dụng brentuximab vedotin trước và 36% bệnh nhân đã được xạ trị trước đó. Các kiểu phụ của bệnh gồm 80% xơ hạt (nodular sclerosis), 11% tế bào hỗn hợp (mixed cellularity), 4% giàu tế bào lympho (lymphocyte-rich) và 2% cạn kiệt tế bào lympho (lymphocyte-depleted).
Trong số những bệnh nhân của nghiên cứu KEYNOTE-013, các đặc điểm ban đầu là: tuổi trung vị là 32 tuổi (7% từ 65 tuổi trở lên), 58% là nam giới, 94% là người da trắng; 45% và 55% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG theo thứ tự là 0 và 1. Số trung vị của các bước điều trị trước đó đã dùng trong điều trị u lympho Hodgkin kinh điển là 5 (khoảng 2-15). 87% bệnh nhân kháng trị với ít nhất 1 dòng điều trị, bao gồm 39% bệnh nhân kháng trị với điều trị bước một. 74% bệnh nhân đã được ghép tế bào gốc tự thân (Auto-SCT), 26% không đủ điều kiện để ghép và 42% bệnh nhân đã được xạ trị trước đó. Các kiểu phụ của bệnh gồm 97% xơ hạt (nodular sclerosis) và 3% tế bào hỗn hợp (mixed cellularity).
Đánh giá kết quả về hiệu quả chính (tỷ lệ đáp ứng toàn bộ (ORR) và tỷ lệ thuyên giảm hoàn toàn (CRR)) đã được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR) theo tiêu chuẩn sửa đổi năm 2007 của Nhóm công tác quốc tế (IWG). Đánh giá kết quả về hiệu quả phụ là thời gian đáp ứng, thời gian sống còn không tiến triển bệnh (PFS) và thời gian sống còn toàn bộ (OS). Đáp ứng đã được đánh giá trong các nghiên cứu KEYNOTE-087 và KEYNOTE-013 theo thứ tự mỗi 12 tuần và 8 tuần, với đánh giá sau lúc ban đầu được lên kế hoạch lần đầu tiên ở tuần thứ 12. Các kết quả về hiệu quả được tóm tắt trong
Bảng 15.
- xem Bảng 15
 Độ an toàn và hiệu quả ở bệnh nhân cao tuổi
Độ an toàn và hiệu quả ở bệnh nhân cao tuổi
Nhìn chung, 20 bệnh nhân bị u lympho Hodgkin kinh điển (cHL) ≥ 65 tuổi được điều trị bằng pembrolizumab trong các nghiên cứu KEYNOTE-087 và KEYNOTE-013. Dữ liệu từ những bệnh nhân này còn quá hạn chế để đưa ra bất kỳ kết luận nào về độ an toàn hoặc hiệu quả ở nhóm bệnh nhân này.
U LYMPHO TẾ BÀO B TRUNG THẤT NGUYÊN PHÁT
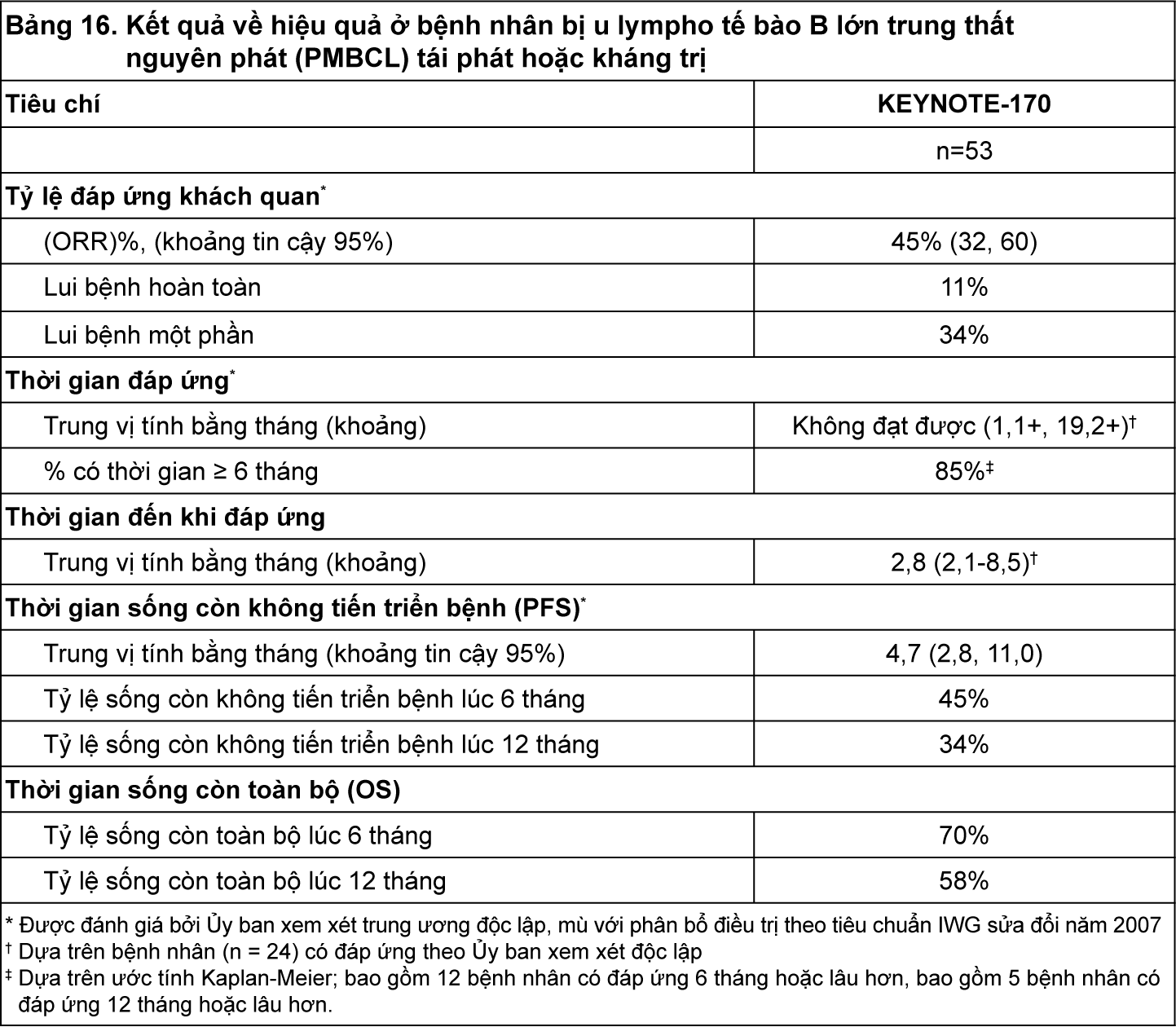
KEYNOTE-170: Nghiên cứu nhãn mở ở bệnh nhân bị u lympho tế bào B lớn trung thất nguyên phát (PMBCL) tái phát hoặc kháng trị
Hiệu quả của KEYTRUDA đã được khảo sát trong nghiên cứu KEYNOTE-170 là một thử nghiệm đa trung tâm, nhãn mở, 1 nhóm ở 53 bệnh nhân bị u lympho tế bào B lớn trung thất nguyên phát (PMBCL) tái phát hoặc kháng trị. Các bệnh nhân bị viêm phổi không do nhiễm khuẩn hoạt động, được ghép tế bào gốc tạo máu (HSCT) cùng loài trong vòng 5 năm qua (hoặc hơn 5 năm nhưng có triệu chứng của bệnh mảnh ghép chống lại vật chủ (GVHD)), bệnh tự miễn hoạt động, một tình trạng y khoa đòi hỏi điều trị bằng liệu pháp ức chế miễn dịch, hoặc nhiễm khuẩn hoạt động đòi hỏi cần điều trị toàn thân là không đủ điều kiện cho thử nghiệm. Các bệnh nhân dùng KEYTRUDA 200 mg mỗi 3 tuần cho đến khi độc tính không thể chấp nhận được hoặc tiến triển bệnh được xác định, hoặc cho đến 24 tháng ở bệnh nhân không có tiến triển bệnh. Đánh giá tình trạng bệnh được thực hiện mỗi 12 tuần. Đánh giá chủ yếu về hiệu quả là (tỷ lệ đáp ứng khách quan (ORR), tỷ lệ đáp ứng hoàn toàn (CRR), thời gian sống còn không tiến triển bệnh (PFS) và thời gian đáp ứng) được đánh giá bởi Ủy ban trung tâm xem xét độc lập, mù với phân bổ điều trị theo tiêu chuẩn IWG sửa đổi năm 2007.
Trong số 53 bệnh nhân, các đặc điểm ban đầu là: tuổi trung vị là 33 tuổi (khoảng từ 20-61), 0% từ 65 tuổi trở lên; 43% là nam giới; 92% là người da trắng; 43% có điểm số tình trạng hoạt động cơ thể (PS) theo thang điểm ECOG là 0 và 57% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 1. Trung vị số bước điều trị trước đây được sử dụng để điều trị u lympho tế bào B lớn trung thất nguyên phát (PMBCL) là 3 (khoảng từ 2-8). 77% kháng trị với liệu pháp cuối cùng trước đó, 40% bị bệnh kháng trị nguyên phát và 89% bị bệnh kháng hóa trị liệu với bất kỳ phác đồ trước đó. 26% bệnh nhân đã được ghép tế bào gốc tạo máu tự thân, 74% không được ghép trước đó và 32% bệnh nhân đã được xạ trị trước đó.
Kết quả về hiệu quả được tóm tắt trong
Bảng 16.
- xem Bảng 16
 UNG THƯ BIỂU MÔ ĐƯỜNG TIẾT NIỆU
KEYNOTE-045: Thử nghiệm có đối chứng ở bệnh nhân ung thư biểu mô đường tiết niệu đã điều trị trước bằng hóa trị liệu có chứa platin
UNG THƯ BIỂU MÔ ĐƯỜNG TIẾT NIỆU
KEYNOTE-045: Thử nghiệm có đối chứng ở bệnh nhân ung thư biểu mô đường tiết niệu đã điều trị trước bằng hóa trị liệu có chứa platin
Độ an toàn và hiệu quả của pembrolizumab đã được đánh giá trong nghiên cứu KEYNOTE-045, một nghiên cứu đa trung tâm, ngẫu nhiên (1:1), có đối chứng về điều trị ung thư biểu mô đường tiết niệu tiến triển tại chỗ hoặc di căn trên những bệnh nhân có bệnh đang tiến triển hoặc sau hóa trị liệu có chứa platin. Các bệnh nhân phải được điều trị bước một bằng phác đồ có chứa platin trong điều trị bệnh tiến triển/di căn hoặc dưới dạng điều trị tân bổ trợ/bổ trợ, với sự tái phát/tiến triển ≤ 12 tháng sau khi hoàn thành điều trị. Các bệnh nhân được chọn ngẫu nhiên (1:1) để dùng KEYTRUDA 200 mg mỗi 3 tuần (n=270) hoặc theo lựa chọn của nhà nghiên cứu cho bất kỳ phác đồ hóa trị liệu nào sau đây, tất cả được tiêm tĩnh mạch mỗi 3 tuần (n=272): paclitaxel 175 mg/m
2 (n=84), docetaxel 75 mg/m
2 (n=84) hoặc vinflunine 320 mg/m
2 (n=87). Các bệnh nhân được điều trị bằng pembrolizumab cho đến khi tiến triển bệnh hoặc độc tính không thể chấp nhận được. Việc điều trị có thể tiếp tục sau khi tiến triển bệnh nếu bệnh nhân ổn định trên lâm sàng và được các nhà nghiên cứu xem là có lợi ích lâm sàng. Những bệnh nhân không tiến triển bệnh có thể được điều trị đến 24 tháng. Nghiên cứu đã loại trừ những bệnh nhân bị bệnh tự miễn, một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch và những bệnh nhân đã được điều trị hơn 2 bước hóa trị liệu toàn thân trước đó đối với ung thư đường tiết niệu di căn. Những bệnh nhân có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 2 phải có hemoglobin ≥ 10 g/dL, không thể bị di căn gan và phải nhận được liều cuối cùng của phác đồ hóa trị liệu cuối cùng trước đó ≥ 3 tháng trước khi đưa vào nghiên cứu. Đánh giá tình trạng khối u đã được thực hiện lúc 9 tuần sau liều đầu tiên, sau đó mỗi 6 tuần cho đến năm thứ nhất, tiếp theo là mỗi 12 tuần sau đó.
Trong số 542 bệnh nhân được chọn ngẫu nhiên trong nghiên cứu KEYNOTE-045, các đặc điểm ban đầu là: tuổi trung vị là 66 tuổi (khoảng: 26-88), 58% từ 65 tuổi trở lên; 74% là nam giới; 72% là người da trắng và 23% là người châu Á; 56% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 1 và 1% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 2; 96% bị bệnh giai đoạn M1 và 4% bị bệnh giai đoạn M0. 87% bệnh nhân có di căn tạng, bao gồm 34% di căn gan. 86% bệnh nhân có khối u nguyên phát ở đường tiết niệu dưới và 14% có khối u nguyên phát ở đường tiết niệu trên. 15% bệnh nhân có sự tiến triển bệnh sau hóa trị liệu tân bổ trợ hoặc bổ trợ có chứa platin. 21% bệnh nhân đã nhận được 2 phác đồ điều trị toàn thân trước đó trong bối cảnh di căn. 76% bệnh nhân đã dùng cisplatin trước đó, 23% đã dùng carboplatin trước đó và 1% đã được điều trị bằng các phác đồ khác có chứa platin.
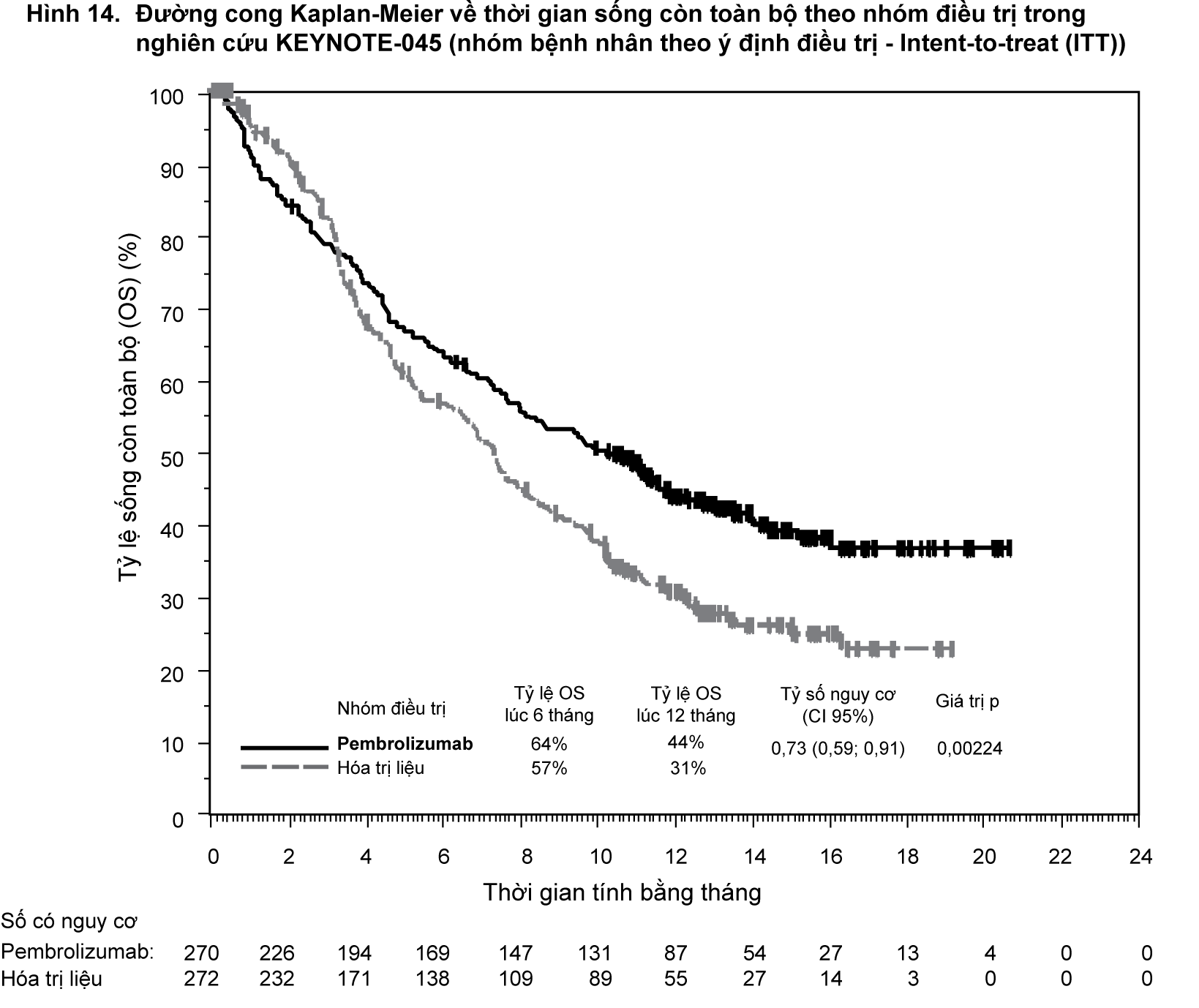
Đánh giá kết quả về hiệu quả chính là thời gian sống còn toàn bộ (OS) và thời gian sống còn không tiến triển bệnh (PFS) như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR) sử dụng RECIST phiên bản 1.1. Đánh giá kết quả về hiệu quả phụ là tỷ lệ đáp ứng toàn bộ (ORR) (như được đánh giá bởi BICR sử dụng RECIST phiên bản 1.1) và thời gian đáp ứng.
Bảng 13 tóm tắt các đánh giá về hiệu quả chính đối với nhóm bệnh nhân theo ý định điều trị (ITT). Đường cong Kaplan-Meier về thời gian sống còn toàn bộ được thể hiện trong
Hình 14. Nghiên cứu đã chứng minh sự cải thiện có ý nghĩa thống kê về thời gian sống còn toàn bộ (OS) và tỷ lệ đáp ứng toàn bộ (ORR) đối với những bệnh nhân được chọn ngẫu nhiên để dùng pembrolizumab khi so với hóa trị liệu. Không có sự khác biệt có ý nghĩa thống kê giữa pembrolizumab và hóa trị về thời gian sống còn không tiến triển bệnh (PFS).
- xem Bảng 17

- xem Hình 14
Một phân tích đã được thực hiện trong nghiên cứu KEYNOTE-045 ở những bệnh nhân có điểm số dương kết hợp (CPS) của biểu hiện PD-L1 < 10% [pembrolizumab: n=186 (69%) so với hóa trị liệu: n=176 (65%)] hoặc ≥ 10% [pembrolizumab: n=74 (27%) so với hóa trị liệu: n=90 (33%)] ở cả hai nhóm được điều trị bằng pembrolizumab và hóa trị liệu.
- xem Bảng 18

Kết quả do bệnh nhân báo cáo (PRO) đã được đánh giá, sử dụng EORTC QLQ-C30 (Bảng câu hỏi đánh giá chất lượng cuộc sống của bệnh nhân ung thư của Tổ chức Nghiên cứu và điều trị ung thư châu Âu). Một thời gian dài cho đến khi suy giảm tình trạng sức khỏe tổng thể/chất lượng cuộc sống (QoL) theo EORTC QLQ-C30 đã được quan sát thấy ở bệnh nhân điều trị bằng pembrolizumab so với hóa trị liệu theo lựa chọn của nhà nghiên cứu (Tỷ số nguy cơ (HR) 0,70; khoảng tin cậy (CI) 95% 0,55-0,90). Sau 15 tuần theo dõi, các bệnh nhân điều trị bằng pembrolizumab có tình trạng sức khỏe tổng thể/chất lượng cuộc sống ổn định, trong khi những người được điều trị bằng hóa trị liệu của nhà nghiên cứu có sự suy sụp tình trạng sức khỏe tổng thể/chất lượng cuộc sống. Nên diễn giải những kết quả này trong bối cảnh của thiết kế nghiên cứu nhãn mở và do đó cần thận trọng.
KEYNOTE-052: Thử nghiệm nhãn mở ở bệnh nhân ung thư biểu mô đường tiết niệu không đủ điều kiện để dùng hóa trị liệu có chứa cisplatin
Độ an toàn và hiệu quả của pembrolizumab đã được khảo sát trong nghiên cứu KEYNOTE-052, một nghiên cứu đa trung tâm, nhãn mở về điều trị ung thư biểu mô đường tiết niệu tiến triển tại chỗ hoặc di căn ở những bệnh nhân không đủ điều kiện để dùng hóa trị liệu có chứa cisplatin. Các bệnh nhân đã dùng pembrolizumab với liều 200 mg mỗi 3 tuần cho đến khi độc tính không thể chấp nhận được hoặc bệnh tiến triển. Việc điều trị có thể tiếp tục sau khi tiến triển bệnh nếu bệnh nhân ổn định trên lâm sàng và được các nhà nghiên cứu xem là có lợi ích lâm sàng. Những bệnh nhân không tiến triển bệnh có thể được điều trị đến 24 tháng. Nghiên cứu đã loại trừ bệnh nhân bị bệnh tự miễn hoặc một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch. Đánh giá tình trạng khối u đã được thực hiện lúc 9 tuần sau liều đầu tiên, sau đó mỗi 6 tuần cho trong năm thứ nhất, tiếp theo là mỗi 12 tuần sau đó.
Trong số 370 bệnh nhân ung thư biểu mô đường tiết niệu không đủ điều kiện để dùng hóa trị liệu có chứa cisplatin, các đặc điểm ban đầu là: tuổi trung vị là 74 tuổi (82% từ 65 tuổi trở lên); 77% là nam giới; 89% là người da trắng và 7% là người châu Á. 87% bị bệnh giai đoạn M1 và 13% bị bệnh giai đoạn M0. 85% bệnh nhân có di căn tạng, bao gồm 21% di căn gan. Lý do không đủ điều kiện dùng cisplatin bao gồm: độ thanh thải creatinin ban đầu < 60 mL/phút (50%), điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 2 (32%), điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 2 và độ thanh thải creatinin ban đầu < 60 mL/phút (9%) và các trường hợp khác (suy tim Độ III, bệnh thần kinh ngoại biên Độ 2 trở lên và mất thính giác Độ 2 trở lên; 9%). 90% bệnh nhân chưa từng điều trị và 10% đã được điều trị trước đó bằng hóa trị liệu bổ trợ hoặc tân bổ trợ có chứa platin. 81% bệnh nhân có khối u nguyên phát ở đường tiết niệu dưới và 19% bệnh nhân có khối u nguyên phát ở đường tiết niệu trên.
Đánh giá kết quả về hiệu quả chính là tỷ lệ đáp ứng toàn bộ (ORR) như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR) sử dụng RECIST 1.1. Đánh giá kết quả về hiệu quả phụ là thời gian đáp ứng, thời gian sống còn không tiến triển bệnh (PFS) và thời gian sống còn toàn bộ (OS).
Bảng 19 tóm tắt các đánh giá về hiệu quả chính đối với nhóm bệnh nhân nghiên cứu dựa trên thời gian theo dõi trung vị 9,5 tháng đối với tất cả bệnh nhân.
- xem Bảng 19

Một phân tích đã được thực hiện trong nghiên cứu KEYNOTE-052 ở những bệnh nhân có PD-L1 CPS < 10% (n=251; 68%) hoặc ≥ 10% (n=110, 30%) .
- xem Bảng 20
 UNG THƯ TẾ BÀO VẢY ĐẦU VÀ CỔ (HNSCC)
UNG THƯ TẾ BÀO VẢY ĐẦU VÀ CỔ (HNSCC)
KEYNOTE-048: Điều trị bước đầu ung thư tế bào vảy đầu và cổ (HNSCC) tái phát, di căn hoặc không thể cắt bỏ
Hiệu quả của KEYTRUDA đã được khảo sát trong nghiên cứu KEYNOTE-048 (NCT02358031) là một thử nghiệm ngẫu nhiên, đa trung tâm, nhãn mở, đối chứng với hoạt chất được tiến hành ở 882 bệnh nhân ung thư tế bào vảy đầu và cổ (HNSCC) di căn chưa được điều trị toàn thân trước đó đối với bệnh di căn hoặc bị bệnh tái phát được xem là những người không thể chữa khỏi bằng liệu pháp tại chỗ. Những bệnh nhân bị bệnh tự miễn hoạt động đòi hỏi liệu pháp toàn thân trong 2 năm điều trị hoặc một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch là không đủ điều kiện. Sự chọn ngẫu nhiên được phân tầng theo biểu hiện PD-L1 của khối u (TPS ≥ 50% hoặc < 50%) dựa trên PD-L1 IHC 22C3 pharmDx kit, tình trạng HPV (Human papillomavirus) theo p16 IHC (dương tính hoặc âm tính), và điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG (0 so với 1). Các bệnh nhân được chọn ngẫu nhiên 1:1:1 vào một trong các nhóm điều trị sau:
• KEYTRUDA 200 mg tiêm truyền tĩnh mạch mỗi 3 tuần
• KEYTRUDA 200 mg tiêm truyền tĩnh mạch mỗi 3 tuần, carboplatin AUC 5 mg/mL/phút tiêm truyền tĩnh mạch mỗi 3 tuần hoặc cisplatin 100 mg/m
2 tiêm truyền tĩnh mạch mỗi 3 tuần, và FU 1000 mg/m
2/ngày dưới dạng truyền tĩnh mạch liên tục trong 96 giờ mỗi 3 giờ tuần (tối đa 6 chu kỳ platin và FU)
• Cetuximab 400 mg/m
2 tiêm truyền tĩnh mạch dưới dạng liều khởi đầu, sau đó 250 mg/m
2 tiêm truyền tĩnh mạch 1 lần mỗi tuần, carboplatin AUC 5 mg/mL/phút tiêm truyền tĩnh mạch mỗi 3 tuần hoặc cisplatin 100 mg/m
2 tiêm truyền tĩnh mạch mỗi 3 tuần và FU 1000 mg/m
2/ngày dưới dạng truyền tĩnh mạch liên tục trong 96 giờ mỗi 3 tuần (tối đa 6 chu kỳ platin và FU)
Điều trị bằng KEYTRUDA tiếp tục cho đến khi tiến triển bệnh được xác định theo RECIST phiên bản 1.1 như được xác định bởi nhà nghiên cứu, độc tính không thể chấp nhận được, hoặc tối đa 24 tháng. Có thể tiếp tục sử dụng KEYTRUDA sau khi tiến triển bệnh được xác định theo RECIST nếu bệnh nhân đã ổn định về lâm sàng và được cho là nhận được lợi ích lâm sàng theo nhà nghiên cứu. Đánh giá tình trạng khối u được thực hiện ở tuần thứ 9 và sau đó mỗi 6 tuần trong năm đầu tiên, sau đó mỗi 9 tuần cho đến 24 tháng. Tái phân loại bằng hồi cứu tình trạng PD-L1 của khối u của bệnh nhân theo điểm số kết hợp dương (CPS) sử dụng PD-L1 IHC 22C3 pharmDx
TM kit được tiến hành bằng cách sử dụng mẫu khối u dùng trong chọn ngẫu nhiên.
Đánh giá kết quả về hiệu quả chính là thời gian sống còn toàn bộ (OS) và thời gian sống còn không tiến triển bệnh (PFS) như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR) theo tiêu chuẩn đánh giá đáp ứng về khối u đặc (RECIST) phiên bản 1.1 (được sửa đổi để theo dõi tối đa 10 tổn thương đích và tối đa 5 tổn thương đích mỗi cơ quan) được thử nghiệm tuần tự ở phân nhóm bệnh nhân có CPS ≥ 20, phân nhóm bệnh nhân có CPS ≥ 1 và nhóm bệnh nhân tổng thể.
Các đặc điểm của nhóm bệnh nhân nghiên cứu là: tuổi trung vị là 61 tuổi (khoảng: 20-94), 36% từ 65 tuổi trở lên; 83% là nam giới; 73% là người da trắng, 20% là người châu Á và 2,4% là người da đen; 61% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 1 và 79% là những người trước đây hút thuốc lá/hiện là người hút thuốc lá. 22% bệnh nhân có khối u dương tính với HPV, 23% có PD-L1 TPS ≥ 50% và 95% bị bệnh giai đoạn IV (giai đoạn IVA 19%, giai đoạn IVB 6% và giai đoạn IVC 70%). 85% bệnh nhân có khối u biểu hiện PD-L1 với CPS ≥ 1 và 43% có CPS ≥ 20.
Thử nghiệm đã cho thấy sự cải thiện có ý nghĩa thống kê về thời gian sống còn toàn bộ đối với những bệnh nhân được chọn ngẫu nhiên dùng KEYTRUDA phối hợp với hóa trị liệu so với những bệnh nhân được chọn ngẫu nhiên dùng cetuximab phối hợp với hóa trị liệu trong phân tích giữa kỳ được xác định trước ở quần thể bệnh nhân chung. Thử nghiệm cũng cho thấy sự cải thiện có ý nghĩa thống kê về thời gian sống còn toàn bộ đối với phân nhóm bệnh nhân có PD-L1 với CPS ≥ 1 được chọn ngẫu nhiên dùng KEYTRUDA dưới dạng thuốc đơn chất so với những bệnh nhân được chọn ngẫu nhiên dùng cetuximab phối hợp với hóa trị liệu. Tại thời điểm phân tích giữa kỳ, không có sự khác biệt có ý nghĩa về thời gian sống còn toàn bộ giữa nhóm dùng thuốc đơn chất KEYTRUDA và nhóm đối chứng đối với nhóm bệnh nhân tổng thể.
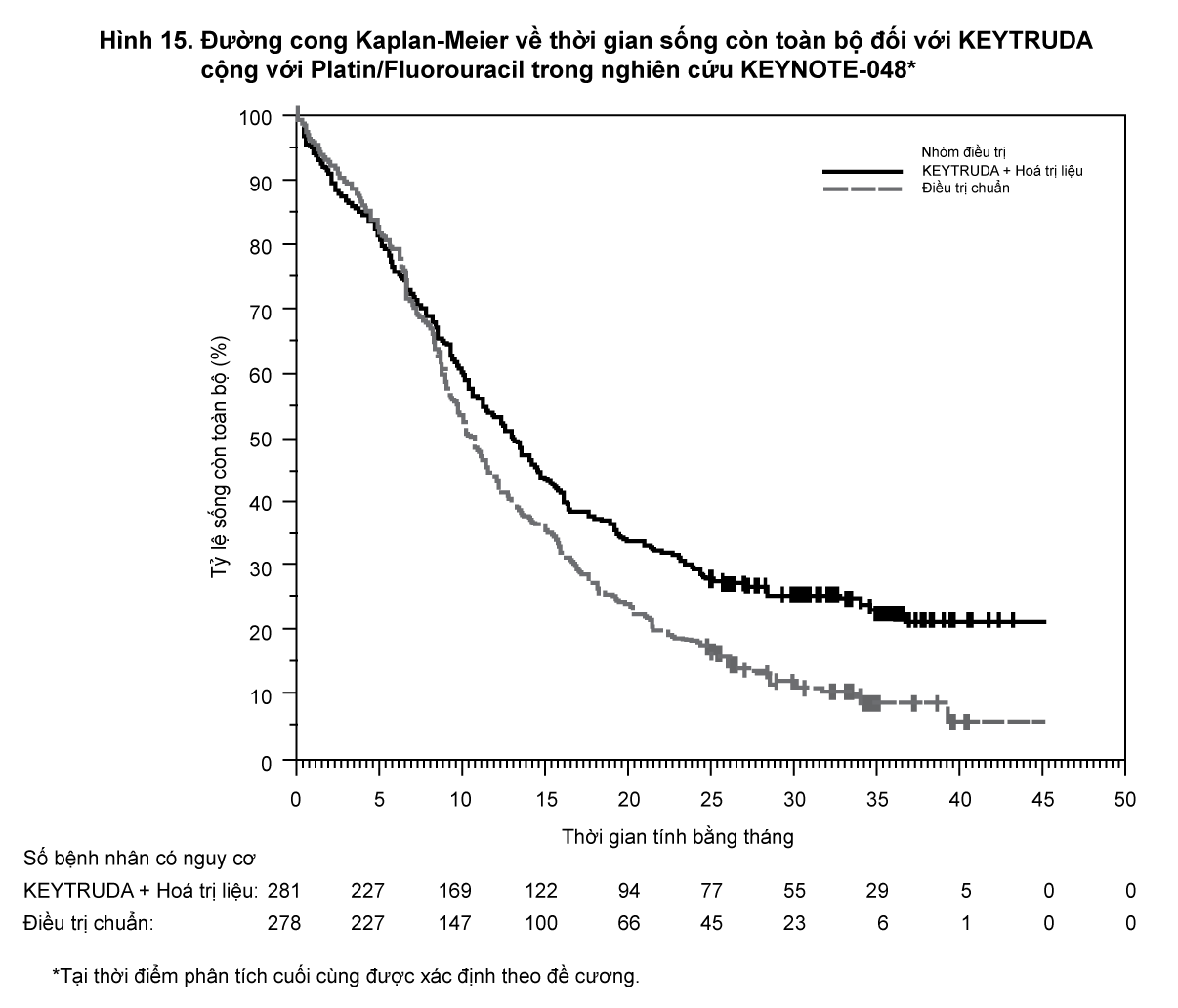
Bảng 21 và
Hình 15 tóm tắt kết quả về hiệu quả đối với KEYTRUDA phối hợp với hóa trị liệu.
- xem Bảng 21

Tại thời điểm phân tích thời gian sống còn toàn bộ (OS) cuối cùng được chỉ định trước cho nhóm Theo ý định điều trị, tỷ số nguy cơ là 0,72 (khoảng tin cậy 95%: 0,60, 0,87). Ngoài ra, KEYNOTE 048 cho thấy sự cải thiện có ý nghĩa thống kê đối với thời gian sống còn toàn bộ (OS) ở các phân nhóm bệnh nhân có CPS ≥ 1 (Tỷ số nguy cơ =0,65, khoảng tin cậy 95%: 0,45, 0,82).
- xem Hình 15
Thử nghiệm cũng cho thấy sự cải thiện có ý nghĩa thống kê về sống còn toàn bộ (OS) đối với phân nhóm bệnh nhân có PD-L1 CPS ≥1 ngẫu nghiên dùng KEYTRUDA như thuốc đơn chất so với những bệnh nhân ngẫu nhiên dùng cetuximab kết hợp với hóa trị ở thời điểm phân tích giữa kỳ được chỉ định trước. Tại thời điểm phân tích giữa kỳ và cuối cùng, không có sự khác biệt đáng kể về sống còn toàn bộ giữa nhánh dùng KEYTRUDA thuốc đơn chất và nhánh đối chứng trên toàn bộ quần thể.
Bảng 22 tóm tắt kết quả hiệu quả của KEYTRUDA như một thuốc đơn chất trong phân nhóm bệnh nhân ung thư tế bào vảy đầu và cổ có CPS ≥1 và CPS ≥20.
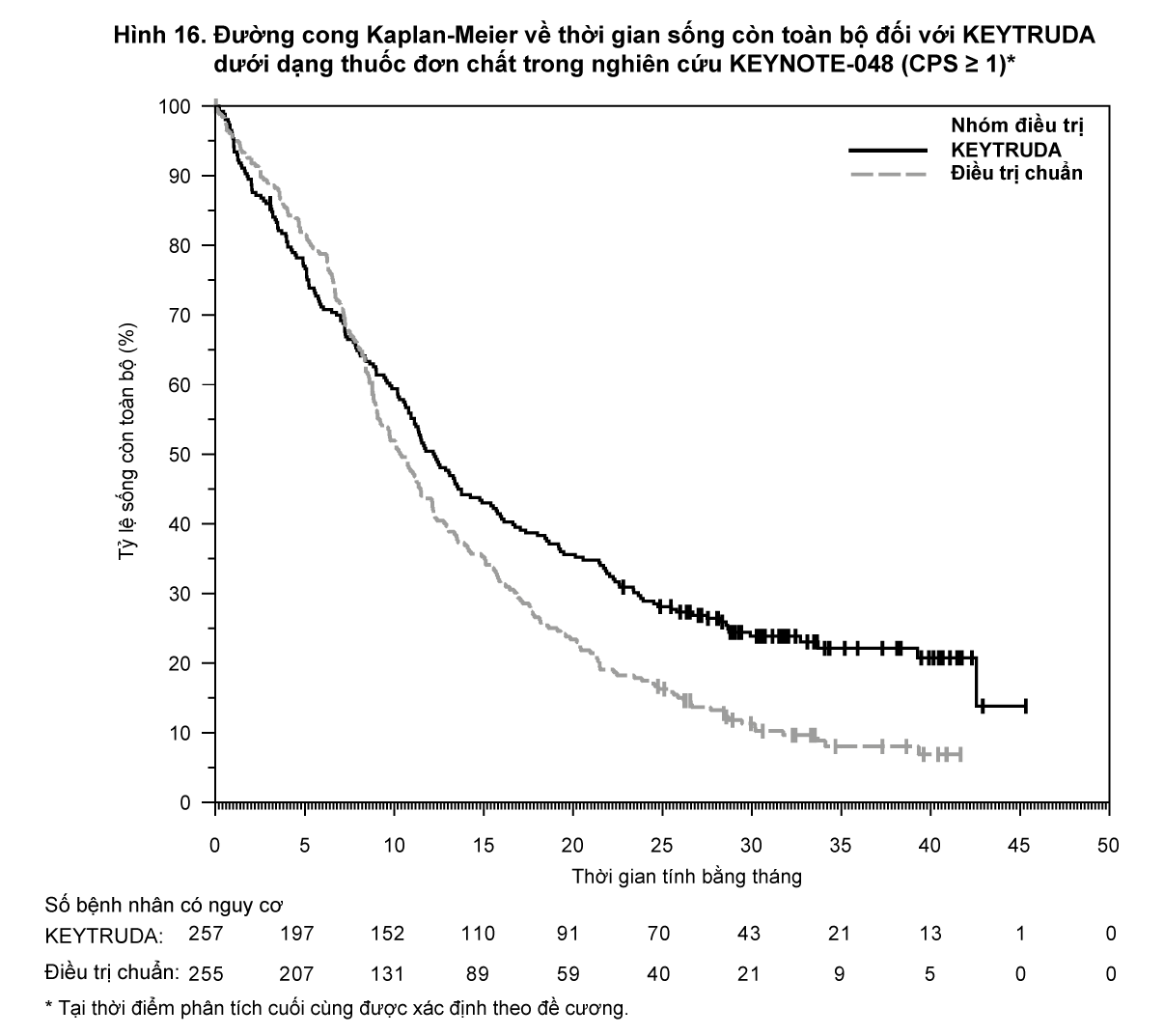
Hình 16 tóm tắt kết quả sống còn toàn bộ ở phân nhóm bệnh nhân ung thư tế bào vảy đầu và cổ có CPS ≥1.
- xem Bảng 22
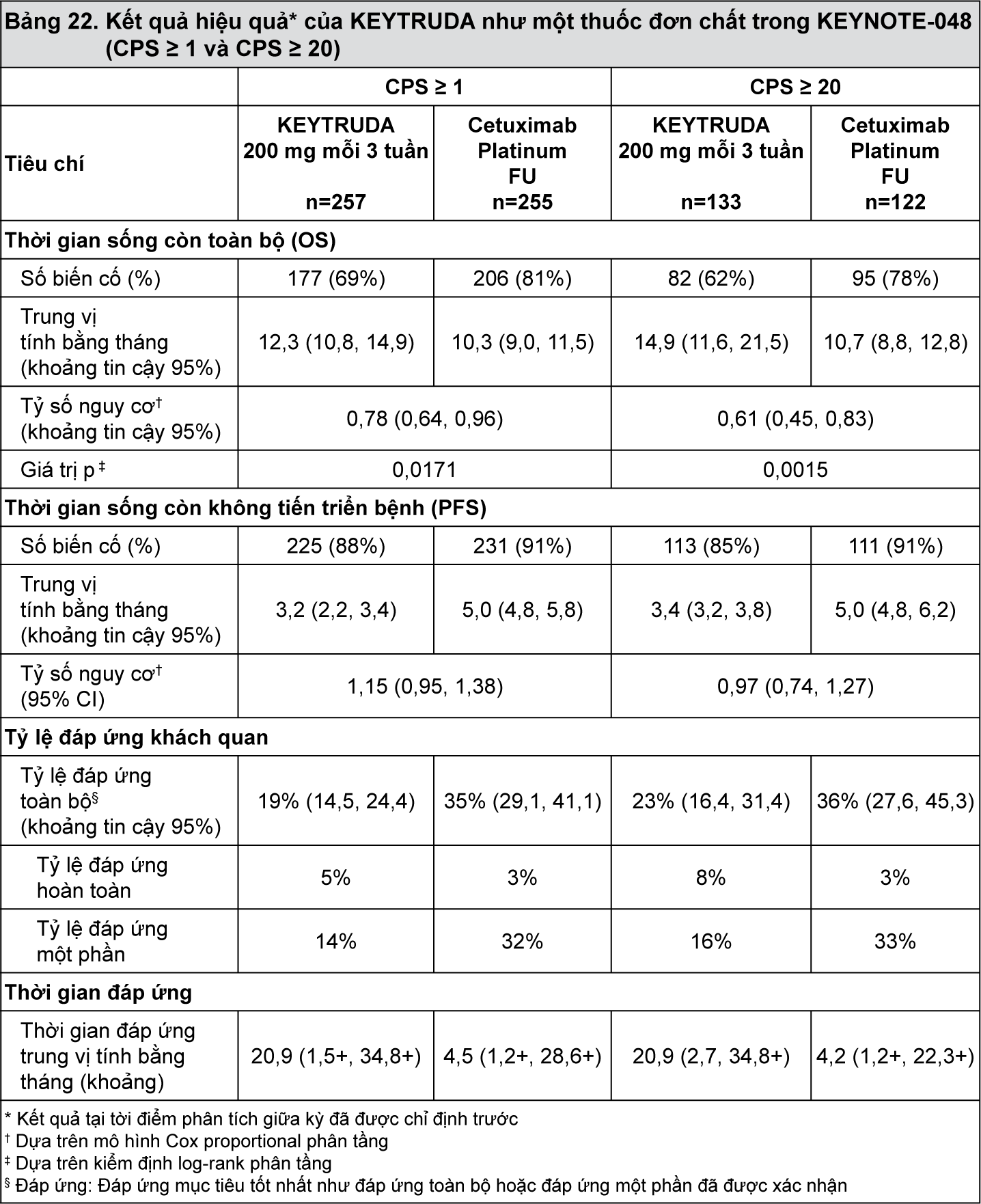
Tại thời điểm phân tích thời gian sống còn toàn bộ (OS) cuối cùng được chỉ định trước so sánh KEYTRUDA như một thuốc đơn chất với hóa trị, tỷ số nguy cơ ở phân nhóm bệnh nhân có CPS ≥ là 0,74 (khoảng tin cậy 95%: 0,61, 0,90) và tỷ số nguy cơ ở phân nhóm bệnh nhân có CPS ≥ 20% là 0,58 (khoảng tin cậy 95%: 0,44, 0,78).
Trong một phân tích phân nhóm thăm dò cho bệnh nhân có CPS 1-19 ở thời điểm phân tích thời gian sống còn toàn bộ (OS) cuối cùng, khoảng trung vị thời gian sống còn toàn bộ là 10,8 tháng (khoảng tin cậy 95%: 9,0, 12,6) đối với KEYTRUDA như một thuốc đơn chất và 10,1 tháng (khoảng tin cậy 95%: 8,7, 12,1) đối với cetuximab kết hợp với hóa trị, với tỷ số nguy cơ 0,86 (khoảng tin cậy 95%:0,66, 1,12).
- xem Hình 16
 KEYNOTE-012: Nghiên cứu nhãn mở ở bệnh nhân ung thư biểu mô tế bào vảy đầu và cổ (HNSCC) đã điều trị trước đây bằng hóa trị liệu
KEYNOTE-012: Nghiên cứu nhãn mở ở bệnh nhân ung thư biểu mô tế bào vảy đầu và cổ (HNSCC) đã điều trị trước đây bằng hóa trị liệu
Hiệu quả của KEYTRUDA đã được khảo sát trong nghiên cứu KEYNOTE-012, một nghiên cứu đa trung tâm, không ngẫu nhiên, nhãn mở, nhiều đoàn hệ, đưa vào nghiên cứu 174 bệnh nhân bị ung thư biểu mô tế bào vảy đầu và cổ tái phát hoặc di căn có sự tiến triển bệnh khi đang dùng hoặc sau điều trị bằng hóa trị liệu có chứa platin được dùng đối với ung thư biểu mô tế bào vảy đầu và cổ tái phát hoặc di căn hoặc sau hóa trị liệu có chứa platin được dùng như một phần của liệu pháp cảm ứng, đồng thời hoặc bổ trợ. Những bệnh nhân bị bệnh tự miễn hoạt động, một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch, bằng chứng về bệnh phổi kẽ hoặc điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG ≥ 2 là không đủ điều kiện.
Các bệnh nhân đã dùng KEYTRUDA 10 mg/kg mỗi 2 tuần (n=53) hoặc 200 mg mỗi 3 tuần (n=121) cho đến khi độc tính không thể chấp nhận được hoặc bệnh tiến triển có triệu chứng, tiến triển nhanh, đòi hỏi can thiệp khẩn cấp, xảy ra với sự suy giảm tình trạng hoạt động cơ thể, hoặc đã được xác định ít nhất 4 tuần sau đó bằng chụp hình ảnh lặp lại. Những bệnh nhân không có tiến triển bệnh đã được điều trị đến 24 tháng.
Có thể bắt đầu lại điều trị bằng pembrolizumab đối với sự tiến triển bệnh sau đó và được dùng thêm đến 1 năm. Đánh giá tình trạng khối u được thực hiện mỗi 8 tuần. Đánh giá kết quả về hiệu quả chính là tỷ lệ đáp ứng toàn bộ (ORR) theo RECIST 1.1, như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR) và thời gian đáp ứng.
Trong số 174 bệnh nhân, các đặc điểm ban đầu là: tuổi trung vị là 60 tuổi (32% từ 65 tuổi trở lên); 82% là nam giới; 75% là người da trắng, 16% là người châu Á, 6% là người da đen; 87% bị bệnh giai đoạn M1; 33% có khối u HPV (human papillomavirus) dương tính; 63% đã điều trị trước bằng cetuximab; 29% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 và 71% điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 1 và số trung vị của các dòng điều trị trước đó trong điều trị ung thư biểu mô tế bào vảy đầu và cổ là 2.
Tỷ lệ đáp ứng toàn bộ (ORR) là 16% (Khoảng tin cậy 95%: 11, 22) với tỷ lệ đáp ứng hoàn toàn là 5%. Thời gian theo dõi trung vị là 8,9 tháng. Trong số 28 bệnh nhân đáp ứng, khoảng thời gian đáp ứng trung vị chưa đạt tới (khoảng: 2,4+ đến 27,7+ tháng), với 23 bệnh nhân có đáp ứng 6 tháng hoặc lâu hơn. Tỷ lệ đáp ứng toàn bộ và thời gian đáp ứng tương tự nhau bất kể phác đồ liều dùng (10 mg/kg mỗi 2 tuần hoặc 200 mg mỗi 3 tuần) hoặc tình trạng HPV.
UNG THƯ DẠ DÀY
KEYNOTE-811: Thử nghiệm có đối chứng về liệu pháp phối hợp ở những bệnh nhân ung thư dạ dày dương tính với HER2 chưa từng điều trị
Hiệu quả của KEYTRUDA kết hợp với trastuzumab cộng với hóa trị liệu có chứa fluoropyrimidine và platin đã được khảo sát trong nghiên cứu KEYNOTE-811, một thử nghiệm đa trung tâm, ngẫu nhiên, mù đôi, đối chứng với giả dược được thiết kế để đưa vào nghiên cứu 692 bệnh nhân ung thư biểu mô tuyến dạ dày hoặc ung thư biểu mô tuyến chỗ nối dạ dày-thực quản (GEJ) tiến triển, HER2 dương tính bất kể tình trạng biểu hiện PD-L1, chưa được điều trị toàn thân trước đây đối với bệnh di căn. Những bệnh nhân bị bệnh tự miễn cần phải điều trị toàn thân trong vòng 2 năm hoặc một tình trạng y khoa cần phải điều trị ức chế miễn dịch là không đủ điều kiện. Việc chọn ngẫu nhiên được phân tầng theo biểu hiện PD-L1 (CPS ≥ 1 hoặc < 1), phác đồ hóa trị liệu (5-FU cộng với cisplatin [FP] hoặc capecitabine cộng với oxaliplatin [CAPOX]) và vùng địa lý (châu Âu/Israel/Bắc Mỹ/Úc, châu Á hoặc vùng còn lại của thế giới). Các bệnh nhân được chọn ngẫu nhiên (1:1) vào một trong các nhóm điều trị sau; tất cả các loại thuốc nghiên cứu, ngoại trừ capecitabine dùng đường uống, được dùng dưới dạng truyền tĩnh mạch cho mỗi chu kỳ 3 tuần:
• KEYTRUDA 200 mg, trastuzumab 8 mg/kg trong lần truyền đầu tiên và 6 mg/kg trong các chu kỳ tiếp theo, sau đó là theo lựa chọn của nhà nghiên cứu về hóa trị liệu kết hợp cisplatin 80 mg/m
2 lên đến 6 chu kỳ và 5-FU 800 mg/m
2/ngày trong 5 ngày (FP) hoặc oxaliplatin 130 mg/m
2 lên đến 6-8 chu kỳ và capecitabine 1.000 mg/m
2 2 lần/ngày trong 14 ngày (CAPOX). KEYTRUDA được dùng trước trastuzumab và hóa trị liệu vào ngày thứ 1 của mỗi chu kỳ.
• Giả dược, trastuzumab 8 mg/kg trong lần truyền đầu tiên và 6 mg/kg trong các chu kỳ tiếp theo, sau đó là theo lựa chọn của nhà nghiên cứu về hóa trị liệu kết hợp cisplatin 80 mg/m
2 lên đến 6 chu kỳ và 5-FU 800 mg/m
2/ngày trong 5 ngày (FP) hoặc oxaliplatin 130 mg/m
2 lên đến 6-8 chu kỳ và capecitabine 1.000 mg/m
2 2 lần/ngày trong 14 ngày (CAPOX). KEYTRUDA được dùng trước trastuzumab và hóa trị liệu vào ngày thứ 1 của mỗi chu kỳ.
Tiếp tục điều trị bằng KEYTRUDA, trastuzumab và hóa trị liệu hoặc giả dược, trastuzumab và hóa trị liệu cho đến khi tiến triển bệnh được xác định theo tiêu chuẩn đánh giá đáp ứng về khối u đặc (RECIST) phiên bản 1.1 như được xác định bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR), độc tính không thể chấp nhận được, hoặc tối đa 24 tháng. Việc điều trị được cho phép sau khi tiến triển bệnh được xác định theo RECIST nếu bệnh nhân ổn định trên lâm sàng và có lợi ích lâm sàng như được xác định bởi nhà nghiên cứu. Đánh giá tình trạng khối u được thực hiện mỗi 6 tuần. Đánh giá kết quả về hiệu quả là tỷ lệ đáp ứng toàn bộ (ORR) và thời gian đáp ứng (DoR) bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị, sử dụng RECIST phiên bản 1.1 được sửa đổi để theo dõi tối đa 10 tổn thương đích và tối đa 5 tổn thương đích mỗi cơ quan.
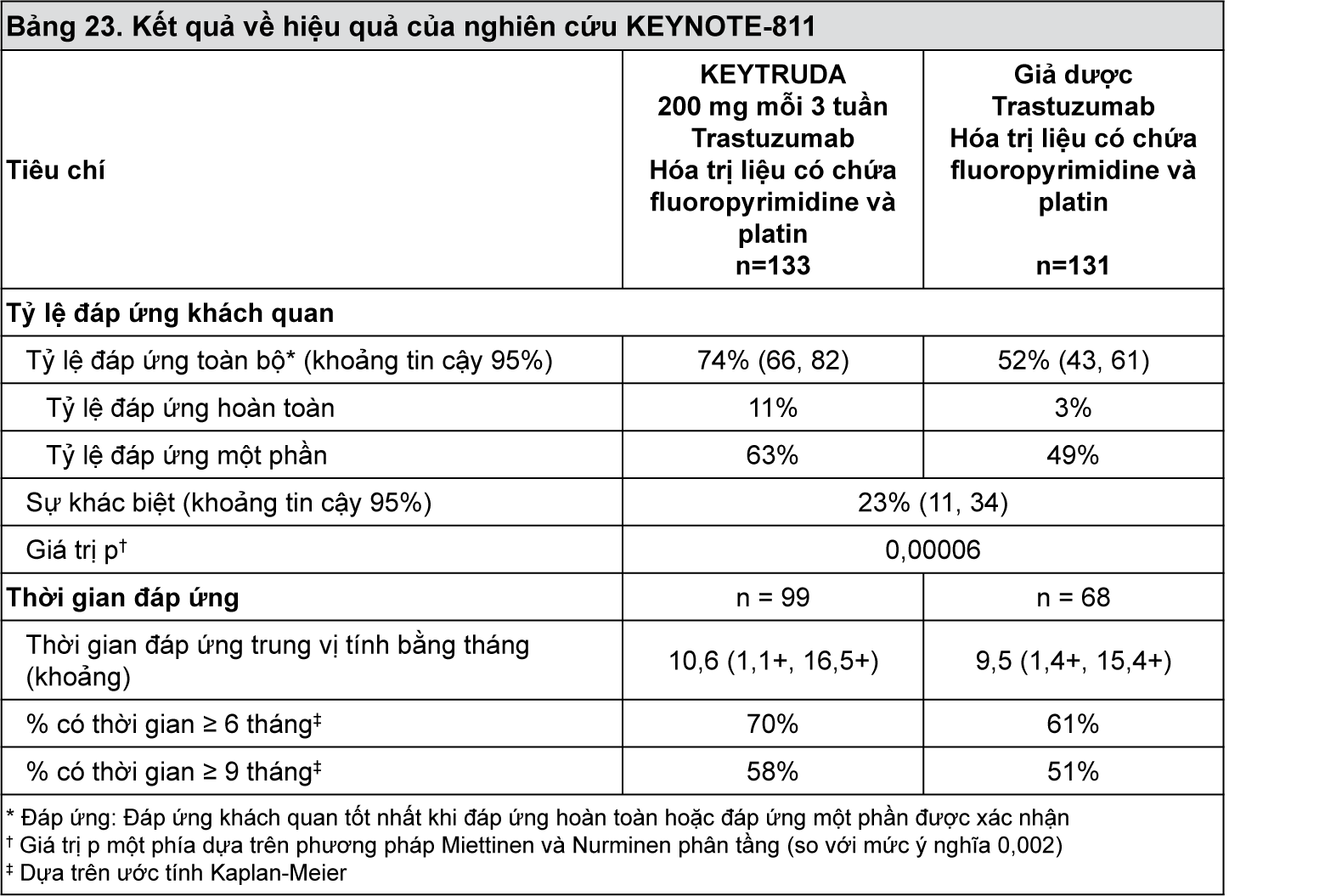
Tại thời điểm phân tích, tỷ lệ đáp ứng toàn bộ và thời gian đáp ứng đã được đánh giá đối với 264 bệnh nhân đầu tiên trong tổng số 434 bệnh nhân được chọn ngẫu nhiên, bao gồm 133 bệnh nhân ở nhóm dùng KEYTRUDA và 131 bệnh nhân ở nhóm dùng giả dược. Theo thiết kế thống kê của nghiên cứu, thời gian sống còn toàn bộ và thời gian sống còn không tiến triển bệnh không được đánh giá trong phân tích giữa kỳ này. Trong số 264 bệnh nhân, các đặc điểm của nhóm bệnh nhân nghiên cứu là: tuổi trung vị là 62 tuổi (khoảng: 19-84), 41% từ 65 tuổi trở lên; 82% là nam giới; 63% là người da trắng, 31% là người châu Á và 0,8% là người da đen; 47% bệnh nhân có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 và 53% bệnh nhân có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 1,97% bệnh nhân bị bệnh di căn (giai đoạn IV) và 3% bị bệnh tiến triển tại chỗ không thể cắt bỏ. 87% bệnh nhân có khối u biểu hiện PD-L1 với CPS ≥ 1. 91% bệnh nhân (n=240) có khối u không có tình trạng mất ổn định vi vệ tinh mức độ cao (MSI-H), 1% bệnh nhân (n=2) có khối u có tình trạng mất ổn định vi vệ tinh mức độ cao và 8% bệnh nhân (n=22) có tình trạng không rõ. 87% bệnh nhân được dùng CAPOX.
Sự cải thiện tỷ lệ đáp ứng toàn bộ có ý nghĩa thống kê đã được chứng minh ở những bệnh nhân được chọn ngẫu nhiên dùng KEYTRUDA kết hợp với trastuzumab và hóa trị liệu so với giả dược kết hợp với trastuzumab và hóa trị liệu. Kết quả về hiệu quả được tóm tắt trong
Bảng 23.
- xem Bảng 23
 KEYNOTE-059: Nghiên cứu nhãn mở ở bệnh nhân ung thư dạ dày đã điều trị trước đây bằng hóa trị liệu
KEYNOTE-059: Nghiên cứu nhãn mở ở bệnh nhân ung thư dạ dày đã điều trị trước đây bằng hóa trị liệu
Hiệu quả của KEYTRUDA đã được khảo sát trong nghiên cứu KEYNOTE-059, một nghiên cứu đa trung tâm, không ngẫu nhiên, nhãn mở, nhiều đoàn hệ, đưa vào nghiên cứu 259 bệnh nhân ung thư biểu mô tuyến dạ dày hoặc ung thư biểu mô tuyến vùng nối dạ dày-thực quản (GEJ) là những người đã tiến triển khi đang dùng ít nhất là 2 liệu pháp điều trị toàn thân trước đó đối với bệnh tiến triển. Điều trị trước đó phải bao gồm một phác đồ 2 thuốc chứa fluoropyrimidine và platin. Những bệnh nhân có HER2/neu dương tính phải được điều trị trước đó bằng liệu pháp nhắm đích HER2/neu đã được phê duyệt. Những bệnh nhân bị bệnh tự miễn hoạt động hoặc một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch hoặc có bằng chứng lâm sàng về cổ trướng khi khám thực thể là không đủ điều kiện.
Các bệnh nhân đã dùng KEYTRUDA 200 mg mỗi 3 tuần cho đến khi độc tính không thể chấp nhận được hoặc bệnh tiến triển có triệu chứng, tiến triển nhanh, đòi hỏi can thiệp khẩn cấp, xảy ra với sự suy giảm tình trạng hoạt động cơ thể, hoặc đã được xác định ít nhất 4 tuần sau đó bằng chụp hình ảnh lặp lại. Những bệnh nhân không có tiến triển bệnh đã được điều trị đến 24 tháng. Đánh giá tình trạng khối u được thực hiện mỗi 6 đến 9 tuần. Đánh giá kết quả về hiệu quả chính là tỷ lệ đáp ứng toàn bộ (ORR) theo RECIST 1.1, như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR) và thời gian đáp ứng.
Trong số 259 bệnh nhân, 55% (n=143) có khối u biểu hiện PD-L1 với điểm số dương kết hợp (CPS) ≥ 1 và tình trạng khối u ổn định vi vệ tinh (MSS - microsatellite stable) hoặc tình trạng mất ổn định vi vệ tinh (MSI - Microsatellite Instability) hoặc sửa chữa bắt cặp sai (MMR - mismatch repair) không xác định. Tình trạng PD-L1 được xác định bằng cách sử dụng PD-L1 IHC 22C3 pharmDx
TM Kit. Các đặc điểm ban đầu của 143 bệnh nhân này là: tuổi trung vị là 64 tuổi (47% từ 65 tuổi trở lên); 77% là nam giới; 82% là người da trắng, 11% là người châu Á và điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 (43%) và 1 (57%). 85% bị bệnh giai đoạn M1 và 7% bị bệnh giai đoạn M0. 51% bệnh nhân nhận được 2 dòng điều trị và 49% bệnh nhân nhận được 3 dòng điều trị hoặc nhiều hơn trước đó trong bối cảnh tái phát hoặc di căn.
Đối với 143 bệnh nhân, tỷ lệ đáp ứng toàn bộ (ORR) là 13,3% (khoảng tin cậy 95%: 8,2; 20,0); 1,4% có đáp ứng hoàn toàn và 11,9% có đáp ứng một phần. Trong số 19 bệnh nhân đáp ứng, thời gian đáp ứng trong khoảng từ 2,8
+ đến 19,4
+ tháng, với 11 bệnh nhân (58%) có đáp ứng 6 tháng hoặc lâu hơn và 5 bệnh nhân (26%) có đáp ứng 12 tháng hoặc lâu hơn.
Trong số 259 bệnh nhân được đưa vào nghiên cứu KEYNOTE-059, 7 bệnh nhân (3%) có khối u được xác định là MSI-H. Đáp ứng mục tiêu đã được quan sát thấy ở 4 bệnh nhân, trong đó có 1 đáp ứng hoàn toàn. Thời gian đáp ứng trong khoảng từ 5,3
+ đến 14,1
+ tháng.
UNG THƯ MẤT ỔN ĐỊNH VI VỆ TINH MỨC ĐỘ CAO (MICROSATELLITE INSTABILITY-HIGH)
Các nghiên cứu nhãn mở KEYNOTE 164 và KEYNOTE 158 ở bệnh nhân ung thư mất ổn định vi vệ tinh mức độ cao (MSI-H), bao gồm khiếm khuyết trong sửa chữa bắt cặp sai (dMMR) đã điều trị trước đây
Hiệu quả của KEYTRUDA đã được khảo sát ở 155 bệnh nhân ung thư mất ổn định vi vệ tinh mức độ cao (MSI-H) hoặc khiếm khuyết trong sửa chữa bắt cặp sai (dMMR) được đưa vào trong 2 nghiên cứu đa trung tâm, không ngẫu nhiên, nhãn mở, nhiều đoàn hệ Pha II (KEYNOTE 164 và KEYNOTE 158). Bất kể về mô học, tình trạng khối u MSI hoặc MMR được xác định bằng cách sử dụng theo thứ tự là phản ứng chuỗi polymerase (PCR) hoặc hóa mô miễn dịch (IHC). Hiệu quả đã được đánh giá ở 61 bệnh nhân được đưa vào nghiên cứu KEYNOTE 164 bị ung thư đại trực tràng (CRC) MSI-H hoặc dMMR (CRC) tiến triển sau điều trị bằng fluoropyrimidine, oxaliplatin và irinotecan. Hiệu quả cũng được đánh giá ở 94 bệnh nhân được đưa vào nghiên cứu KEYNOTE-158 bị ung thư ngoài đại trực tràng (non CRC) MSI-H hoặc dMMR tiến triển đã có tiến triển bệnh sau khi điều trị trước đó. Những bệnh nhân bị bệnh tự miễn hoặc một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch là không đủ điều kiện cho một trong hai thử nghiệm.
Các bệnh nhân đã dùng KEYTRUDA 200 mg mỗi 3 tuần cho đến khi độc tính không thể chấp nhận được hoặc bệnh tiến triển. Những bệnh nhân ổn định trên lâm sàng có bằng chứng ban đầu về tiến triển bệnh được phép tiếp tục điều trị cho đến khi tiến triển bệnh được xác nhận. Những bệnh nhân không có tiến triển bệnh được điều trị đến 24 tháng. Có thể bắt đầu lại việc điều trị bằng KEYTRUDA đối với tiến triển bệnh sau đó và được sử dụng thêm đến 1 năm. Đánh giá tình trạng khối u trong nghiên cứu KEYNOTE 164 được thực hiện mỗi 9 tuần và trong nghiên cứu KEYNOTE 158 mỗi 9 tuần trong suốt năm đầu tiên, sau đó là mỗi 12 tuần. Đánh giá kết quả về hiệu quả chính là tỷ lệ đáp ứng toàn bộ (ORR) và thời gian đáp ứng theo RECIST 1.1.
Trong số 155 bệnh nhân ung thư mất ổn định vi vệ tinh mức độ cao (MSI-H), các đặc điểm ban đầu là: tuổi trung vị là 60 tuổi (40% từ 65 tuổi trở lên); 55% là nam giới; 78% là người da trắng, 20% là người châu Á và điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 (49%) và 1 (51%). 93% bệnh nhân bị bệnh giai đoạn M1 và 6% bệnh nhân bị bệnh giai đoạn M0. 90% bệnh nhân bị ung thư đại trực tràng và 51% bệnh nhân ung thư ngoài đại trực tràng (non CRC) đã nhận được 2 dòng điều trị hoặc nhiều hơn trước đó.
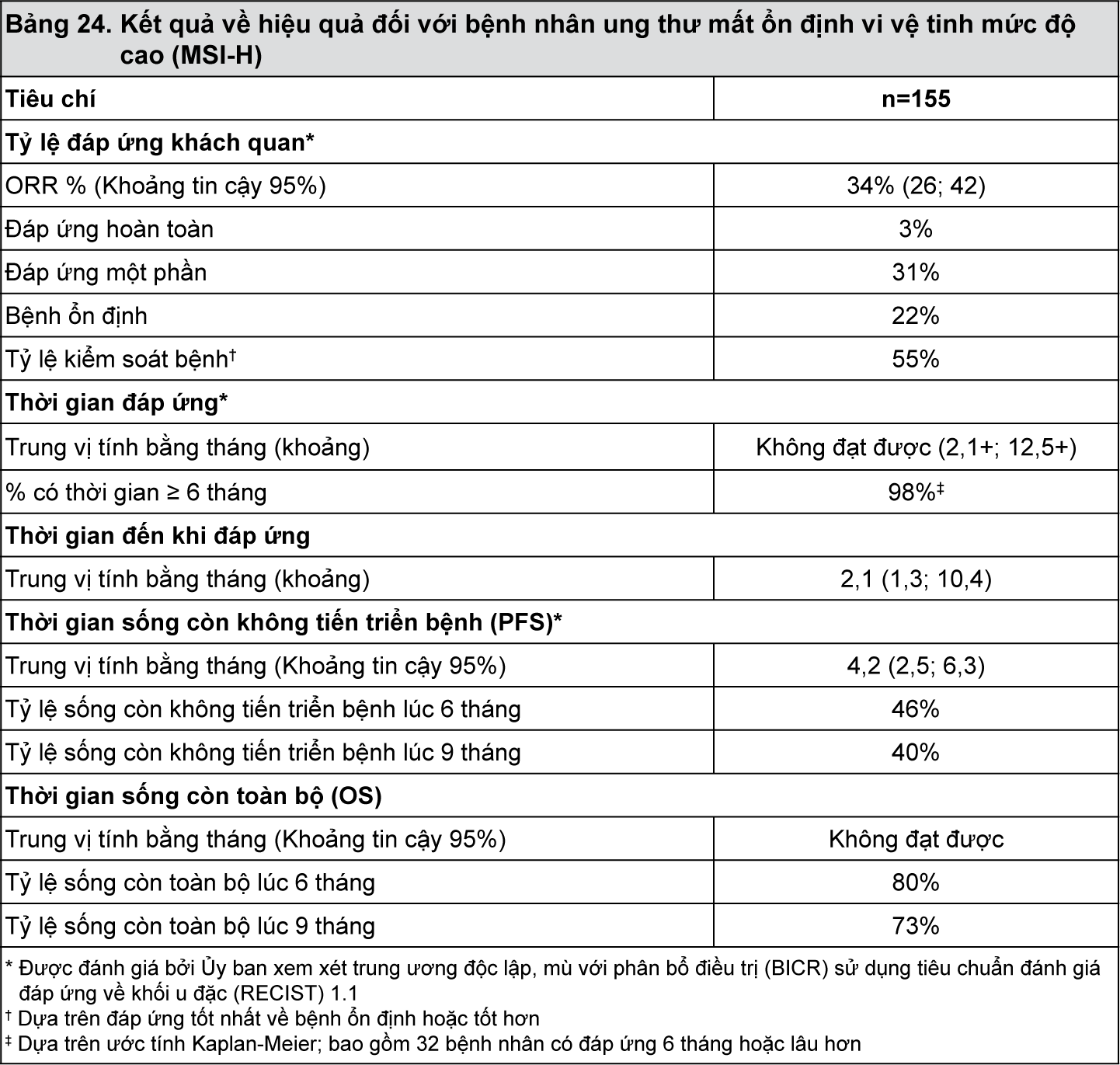
Thời gian theo dõi trung vị đối với 155 bệnh nhân được điều trị bằng KEYTRUDA là 9,7 tháng. Kết quả về hiệu quả được tóm tắt trong
Bảng 24 và
Bảng 25.
- xem Bảng 24
- xem Bảng 25
 UNG THƯ ĐẠI-TRỰC TRÀNG CÓ TÌNH TRẠNG MẤT ỔN ĐỊNH VI VỆ TINH MỨC ĐỘ CAO HOẶC KHIẾM KHUYẾT TRONG SỬA CHỮA BẮT CẶP SAI
KEYNOTE 177: Thử nghiệm có đối chứng về điều trị bước 1 cho những bệnh nhân ung thư đại-trực tràng (CRC) có tình trạng mất ổn định vi vệ tinh mức độ cao (MSI-H) hoặc khiếm khuyết trong sửa chữa bắt cặp sai (dMMR)
UNG THƯ ĐẠI-TRỰC TRÀNG CÓ TÌNH TRẠNG MẤT ỔN ĐỊNH VI VỆ TINH MỨC ĐỘ CAO HOẶC KHIẾM KHUYẾT TRONG SỬA CHỮA BẮT CẶP SAI
KEYNOTE 177: Thử nghiệm có đối chứng về điều trị bước 1 cho những bệnh nhân ung thư đại-trực tràng (CRC) có tình trạng mất ổn định vi vệ tinh mức độ cao (MSI-H) hoặc khiếm khuyết trong sửa chữa bắt cặp sai (dMMR)
Hiệu quả của KEYTRUDA đã được khảo sát trong nghiên cứu KEYNOTE 177, một thử nghiệm đa trung tâm, ngẫu nhiên, nhãn mở, đối chứng với hoạt chất, đưa vào nghiên cứu 307 bệnh nhân ung thư đại-trực tràng (CRC) có tình trạng mất ổn định vi vệ tinh mức độ cao (MSI-H) hoặc khiếm khuyết trong sửa chữa bắt cặp sai (dMMR) chưa được điều trị trước đây, không thể cắt bỏ hoặc di căn. Khối u có tình trạng MSI hoặc MMR được xác định tại chỗ bằng cách sử dụng phản ứng chuỗi polymerase (PCR) hoặc hóa mô miễn dịch (IHC) theo thứ tự tương ứng. Những bệnh nhân bị bệnh tự miễn hoặc một tình trạng y khoa cần phải điều trị ức chế miễn dịch là không đủ điều kiện.
Các bệnh nhân được chọn ngẫu nhiên (1:1) dùng KEYTRUDA 200 mg tiêm truyền tĩnh mạch mỗi 3 tuần hoặc theo lựa chọn của nhà nghiên cứu về các phác đồ hóa trị liệu sau đây được dùng tiêm truyền tĩnh mạch mỗi 2 tuần:
• mFOLFOX6 (oxaliplatin, leucovorin và FU) hoặc mFOLFOX6 kết hợp với bevacizumab hoặc cetuximab: Oxaliplatin 85 mg/m
2, leucovorin 400 mg/m
2 (hoặc levoleucovorin 200 mg/m
2) và FU 400 mg/m
2 tiêm bolus vào ngày thứ 1, sau đó FU 2.400 mg/m
2 trong 46-48 giờ. Bevacizumab 5 mg/kg vào ngày thứ 1 hoặc cetuximab 400 mg/m
2 trong lần truyền đầu tiên, sau đó 250 mg/m
2 mỗi tuần.
• FOLFIRI (irinotecan, leucovorin và FU) hoặc FOLFIRI kết hợp với bevacizumab hoặc cetuximab: Irinotecan 180 mg/m
2, leucovorin 400 mg/m
2 (hoặc levoleucovorin 200 mg/m
2) và FU 400 mg/m
2 tiêm bolus vào ngày thứ 1, sau đó FU 2.400 mg/m
2 trong 46-48 giờ. Bevacizumab 5 mg/kg vào ngày thứ 1 hoặc cetuximab 400 mg/m
2 trong lần truyền đầu tiên, sau đó 250 mg/m
2 mỗi tuần.
Tiếp tục điều trị bằng KEYTRUDA hoặc hóa trị liệu cho đến khi tiến triển bệnh được xác định theo tiêu chuẩn đánh giá đáp ứng về khối u đặc (RECIST) phiên bản 1.1 như được xác định bởi nhà nghiên cứu hoặc độc tính không thể chấp nhận được. Những bệnh nhân được điều trị bằng KEYTRUDA mà không có tiến triển bệnh có thể được điều trị lên đến 24 tháng. Đánh giá tình trạng khối u được thực hiện mỗi 9 tuần. Những bệnh nhân được chọn ngẫu nhiên dùng hóa trị liệu được dùng KEYTRUDA tại thời điểm tiến triển bệnh. Đánh giá kết quả về hiệu quả chính bao gồm thời gian sống còn không tiến triển bệnh được đánh giá theo RECIST phiên bản 1.1 bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR), đánh giá kết quả về hiệu quả phụ là tỷ lệ đáp ứng toàn bộ và thời gian đáp ứng.
Tổng cộng có 307 bệnh nhân được đưa vào nghiên cứu và được chọn ngẫu nhiên dùng KEYTRUDA (n=153) hoặc hóa trị liệu (n=154). Các đặc điểm ban đầu của 307 bệnh nhân này là: tuổi trung vị là 63 tuổi (khoảng: 24-93), 47% từ 65 tuổi trở lên; 50% là nam giới; 75% là người da trắng và 16% là người châu Á; 52% bệnh nhân có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 và 48% bệnh nhân có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 1. Tình trạng đột biến: 25% BRAF V600E, 24% KRAS/NRAS. Đối với 143 bệnh nhân được điều trị bằng hóa trị liệu, 56% dùng mFOLFOX6 có hoặc không có bevacizumab hoặc cetuximab và 44% dùng FOLFIRI có hoặc không có bevacizumab hoặc cetuximab.
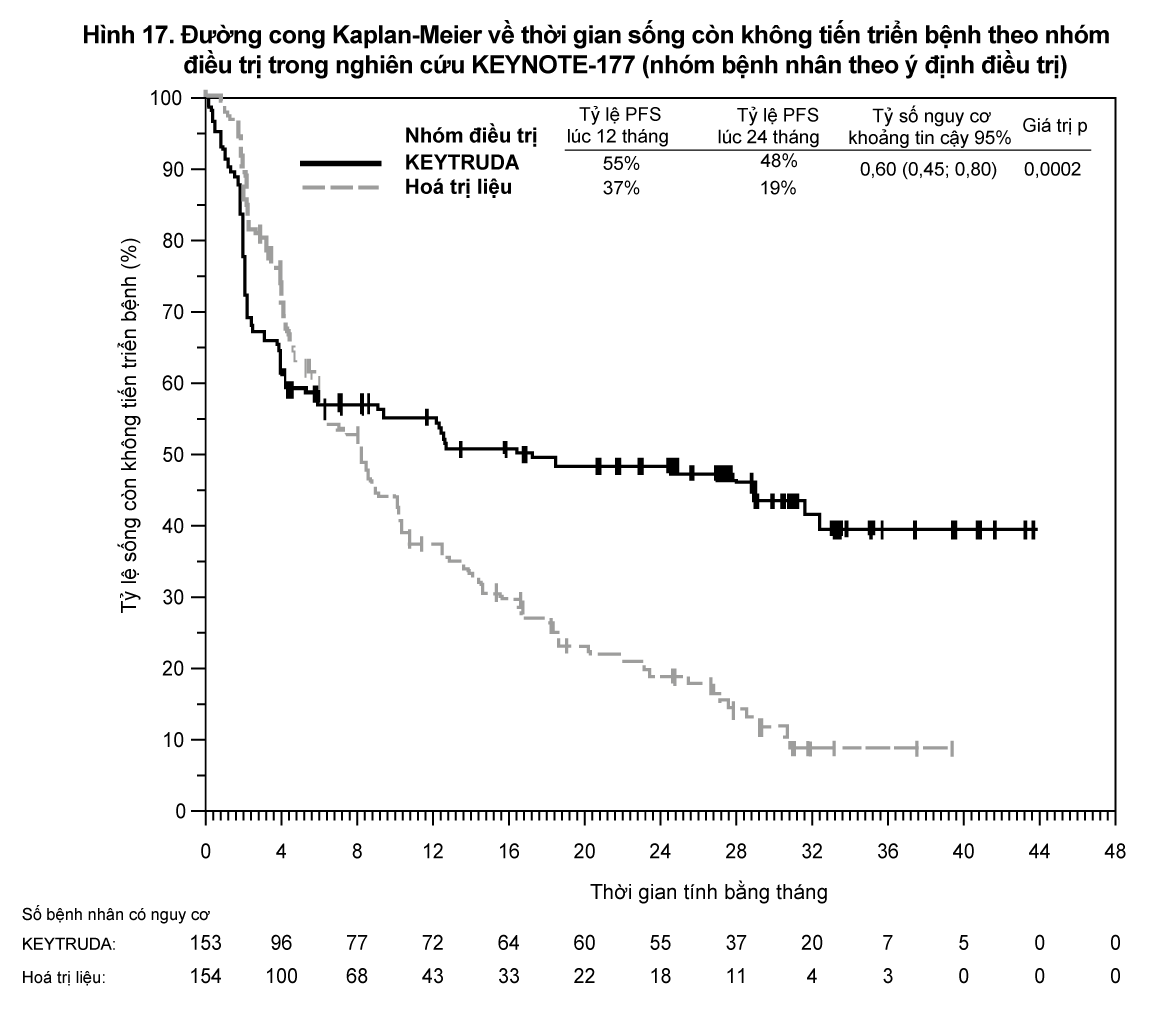
Thử nghiệm đã cho thấy sự cải thiện có ý nghĩa thống kê về thời gian sống còn không tiến triển bệnh đối với những bệnh nhân được chọn ngẫu nhiên dùng KEYTRUDA so với hóa trị liệu. Thời gian theo dõi trung vị là 27,6 tháng (khoảng: 0,2-48,3 tháng).
Bảng 26 và
Hình 17 tóm tắt các đánh giá về hiệu quả chính của nghiên cứu KEYNOTE 177.
- xem Bảng 26

- xem Hình 17
Các phân tích thăm dò về kết quả do bệnh nhân báo cáo (PRO) sử dụng EORTC QLQ-C30 (Bảng câu hỏi đánh giá chất lượng cuộc sống của bệnh nhân ung thư của Tổ chức Nghiên cứu và điều trị ung thư châu Âu) cho thấy sự cải thiện về tình trạng sức khỏe chung/chất lượng cuộc sống, chức năng (tức là thể chất, vai trò, xã hội) và mệt mỏi ở bệnh nhân được điều trị bằng KEYTRUDA so với suy giảm ở bệnh nhân được điều trị bằng hóa trị liệu ở tuần thứ 18 được xác định trước. Sự cải thiện so với ban đầu về tình trạng sức khỏe chung/chất lượng cuộc sống tiếp tục cho đến tuần thứ 45 đối với những bệnh nhân được điều trị bằng KEYTRUDA. Ngoài ra, một thời gian kéo dài cho đến khi suy giảm tình trạng sức khỏe chung/chất lượng cuộc sống (tỷ số nguy cơ 0,61; khoảng tin cậy 95% 0,38-0,98), chức năng thể chất (tỷ số nguy cơ 0,50; khoảng tin cậy 95% 0,32-0,81), chức năng xã hội (tỷ số nguy cơ 0,53; khoảng tin cậy 95% 0,32-0,87) và mệt mỏi (tỷ số nguy cơ 0,48; khoảng tin cậy 95% 0,33-0,69) đã được quan sát thấy ở những bệnh nhân điều trị bằng KEYTRUDA so với hóa trị liệu. Những kết quả này nên được diễn giải trong bối cảnh của thiết kế nghiên cứu nhãn mở và do đó cần thận trọng.
UNG THƯ BIỂU MÔ TẾ BÀO GAN
KEYNOTE 224 Nghiên cứu nhãn mở ở bệnh nhân ung thư biểu mô tế bào gan (HCC), đã điều trị trước đây bằng sorafenib là thuốc ức chế tyrosine kinase (TKI), chống tạo mạch
Hiệu quả của KEYTRUDA đã được khảo sát trong nghiên cứu KEYNOTE 224, một thử nghiệm ở 1 nhóm, nhãn mở, đa trung tâm ở 104 bệnh nhân bị ung thư biểu mô tế bào gan (HCC) có tiến triển bệnh khi đang điều trị hoặc sau khi điều trị bằng sorafenib, một thuốc ức chế tyrosine kinase (TKI) chống tăng sinh mạch, hoặc không dung nạp với sorafenib. Tiêu chuẩn đủ điều kiện bổ sung bao gồm có ít nhất một tổn thương có thể đánh giá, được xác nhận bởi nhà cung cấp hình ảnh trung tâm theo RECIST 1.1 và Child Pugh loại A. Những bệnh nhân bị nhiễm virus viêm gan B (HBV) hoạt động và không hoạt động cũng như những bệnh nhân bị nhiễm virus viêm gan C (HCV) trước đây hoặc đang diễn ra là đủ điều kiện cho thử nghiệm. Những bệnh nhân bị bệnh tự miễn hoạt động, nhiều hơn một nguyên nhân gây viêm gan hoặc một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch hoặc có bằng chứng lâm sàng về cổ trướng khi khám thực thể là không đủ điều kiện cho thử nghiệm.
Các bệnh nhân đã dùng KEYTRUDA 200 mg mỗi 3 tuần cho đến khi độc tính không thể chấp nhận được hoặc bệnh tiến triển. Những bệnh nhân không có tiến triển bệnh đã được điều trị đến 24 tháng. Đánh giá tình trạng khối u được thực hiện mỗi 9 tuần. Đánh giá kết quả về hiệu quả chính là tỷ lệ đáp ứng toàn bộ (ORR) theo RECIST 1.1, như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR) và thời gian đáp ứng.
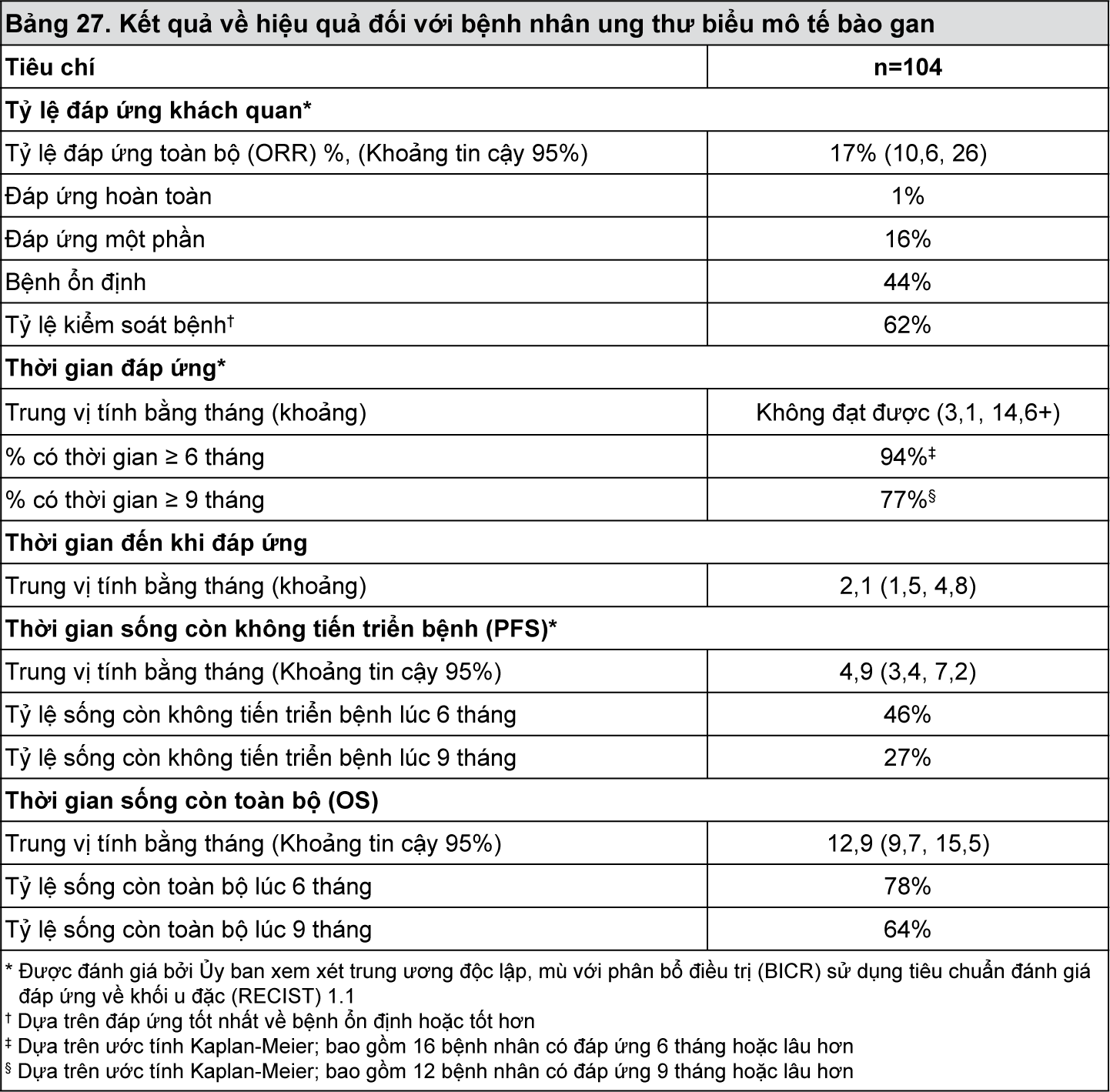
Trong số 104 bệnh nhân được điều trị, các đặc điểm ban đầu là: tuổi trung vị là 68 tuổi (67% từ 65 tuổi trở lên); 83% là nam giới; 81% là người da trắng, 14% là người châu Á; điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 (61%) hoặc 1 (39%); Child Pugh loại A (94%) và B (6%); 21% có HBV dương tính (hoạt động hoặc không hoạt động) và 25% có HCV âm tính (trước đây hoặc đang diễn ra). Sáu mươi tư phần trăm (64%) bệnh nhân bị bệnh ngoài gan, 17% có xâm lấn mạch và 41% có nồng độ alfa-fetoprotein (AFP) lớn hơn 200 ng/mL. Tiền sử điều trị trước đó bao gồm phẫu thuật (33%), xạ trị (14%) hoặc điều trị tại chỗ-vùng (39%). Tất cả các bệnh nhân đã dùng sorafenib trước đó; lý do ngừng điều trị là không dung nạp ở 21 bệnh nhân (20%) và bệnh tiến triển ở 83 bệnh nhân (80%).
Kết quả về hiệu quả được tóm tắt trong
Bảng 27.
- xem Bảng 27
 UNG THƯ CỔ TỬ CUNG
KEYNOTE-158: Nghiên cứu nhãn mở ở bệnh nhân ung thư cổ tử cung đã điều trị trước đây bằng hóa trị liệu
UNG THƯ CỔ TỬ CUNG
KEYNOTE-158: Nghiên cứu nhãn mở ở bệnh nhân ung thư cổ tử cung đã điều trị trước đây bằng hóa trị liệu
Hiệu quả của KEYTRUDA đã được khảo sát ở 98 bệnh nhân ung thư cổ tử cung tái phát hoặc di căn được đưa vào trong một đoàn hệ ở nghiên cứu KEYNOTE-158, một thử nghiệm đa trung tâm, không ngẫu nhiên, nhãn mở, nhiều đoàn hệ. Thử nghiệm đã loại trừ những bệnh nhân bị bệnh tự miễn hoặc một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch.
Các bệnh nhân đã dùng KEYTRUDA ở liều 200 mg mỗi 3 tuần cho đến khi độc tính không thể chấp nhận được hoặc bệnh tiến triển. Những bệnh nhân ổn định trên lâm sàng có bằng chứng ban đầu về tiến triển bệnh được phép tiếp tục điều trị cho đến khi tiến triển bệnh được xác nhận. Những bệnh nhân không có tiến triển bệnh được điều trị đến 24 tháng. Đánh giá tình trạng khối u được thực hiện mỗi 9 tuần trong 12 tháng đầu tiên và mỗi 12 tuần sau đó. Đánh giá kết quả về hiệu quả chính là tỷ lệ đáp ứng toàn bộ (ORR) theo RECIST 1.1, như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị, và thời gian đáp ứng.
Trong số 98 bệnh nhân ung thư cổ tử cung, 77 bệnh nhân (79%) có khối u biểu hiện PD-L1 với điểm số dương kết hợp (CPS) ≥ 1 nhận được ít nhất là 1 dòng hóa trị liệu đối với bệnh tái phát hoặc di căn. Tình trạng PD-L1 được xác định bằng cách sử dụng PD-L1 IHC 22C3 pharmDx Kit. Các đặc điểm ban đầu của 77 bệnh nhân này là: tuổi trung vị là 45 tuổi (khoảng từ 27-75 tuổi); 81% là người da trắng, 14% là người châu Á, 3% là người da đen; điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 (32%) và 1 (68%); 92% bị ung thư biểu mô tế bào vảy, 6% bị ung thư biểu mô tuyến và 1% có mô học tế bào tuyến-vảy; 95% bị bệnh giai đoạn M1 và 5% bị bệnh tái phát; 35% bệnh nhân nhận được 1 dòng điều trị và 65% bệnh nhân nhận được 2 dòng điều trị trước đó hoặc nhiều hơn trong bối cảnh tái phát hoặc di căn.
Không có đáp ứng nào được quan sát thấy ở những bệnh nhân có khối u không có biểu hiện PD-L1 (CPS < 1) (n=15).
Thời gian theo dõi trung vị ở bệnh nhân có biểu hiện PD-L1 (CPS ≥ 1) và nhận được ít nhất 1 dòng điều trị đối với bệnh tái phát hoặc di căn là 11,7 tháng.
Kết quả về hiệu quả được tóm tắt trong
Bảng 28.
- xem Bảng 28
 UNG THƯ THỰC QUẢN
KEYNOTE-590: Điều trị bước 1 ung thư thực quản/chỗ nối dạ dày-thực quản tiến triển tại chỗ không thể cắt bỏ hoặc di căn
UNG THƯ THỰC QUẢN
KEYNOTE-590: Điều trị bước 1 ung thư thực quản/chỗ nối dạ dày-thực quản tiến triển tại chỗ không thể cắt bỏ hoặc di căn
Hiệu quả của KEYTRUDA đã được khảo sát trong nghiên cứu KEYNOTE-590, một thử nghiệm đa trung tâm, ngẫu nhiên, đối chứng với giả dược đưa vào nghiên cứu 749 bệnh nhân dưới dạng điều trị bước 1 ở những bệnh nhân ung thư biểu mô thực quản và chỗ nối dạ dày-thực quản tiến triển tại chỗ không thể cắt bỏ hoặc di căn. Tất cả bệnh nhân cần phải có mẫu khối u để xét nghiệm PD-L1 tại phòng xét nghiệm trung tâm; tình trạng PD-L1 được xác định bằng cách sử dụng bộ kit PD-L1 IHC 22C3 pharmDx
TM. Những bệnh nhân mắc bệnh tự miễn hoạt động, một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch, hoặc bệnh nhân ung thư biểu mô tuyến chỗ nối dạ dày-thực quản HER-2 dương tính đã biết là không đủ điều kiện. Việc chọn ngẫu nhiên được phân tầng theo mô học của khối u (ung thư biểu mô tế bào vảy so với ung thư biểu mô tuyến, vùng địa lý (châu Á so với ngoài châu Á và tình trạng hoạt động cơ thể theo thang điểm ECOG (0 so với 1)).
Các bệnh nhân được phân ngẫu nhiên (1:1) vào một trong các nhóm điều trị sau; tất cả các thuốc nghiên cứu được dùng qua tiêm truyền tĩnh mạch:
• KEYTRUDA 200 mg vào ngày thứ 1 của mỗi chu kỳ 3 tuần kết hợp với cisplatin 80 mg/m
2 tiêm truyền tĩnh mạch vào ngày thứ 1 của mỗi chu kỳ 3 tuần lên đến 6 chu kỳ và 5-FU 800 mg/m
2 tiêm truyền tĩnh mạch mỗi ngày vào ngày thứ 1 đến ngày thứ 5 của mỗi chu kỳ 3 tuần, hoặc theo tiêu chuẩn của địa phương về sử dụng 5-FU, lên đến 24 tháng.
• Giả dược vào ngày thứ 1 của mỗi chu kỳ 3 tuần kết hợp với cisplatin 80 mg/m
2 tiêm truyền tĩnh mạch vào ngày thứ 1 của mỗi chu kỳ 3 tuần lên đến 6 chu kỳ và 5-FU 800 mg/m
2 tiêm truyền tĩnh mạch mỗi ngày vào ngày thứ 1 đến ngày thứ 5 của mỗi chu kỳ 3 tuần, hoặc theo tiêu chuẩn của địa phương về sử dụng 5-FU, lên đến 24 tháng.
Tiếp tục điều trị bằng KEYTRUDA hoặc hóa trị liệu cho đến khi độc tính không thể chấp nhận được hoặc tiến triển bệnh. Các bệnh nhân được chọn ngẫu nhiên dùng KEYTRUDA có thể tiếp tục điều trị sau khi tiến triển bệnh được xác định theo tiêu chuẩn đánh giá đáp ứng về khối u đặc (RECIST) phiên bản 1.1 đầu tiên nếu bệnh nhân đã ổn định trên lâm sàng cho đến khi bằng chứng trên phim X-quang đầu tiên về tiến triển bệnh được xác nhận ít nhất 4 tuần sau đó bằng chụp hình ảnh lặp lại. Những bệnh nhân điều trị bằng KEYTRUDA không có tiến triển bệnh có thể được điều trị đến 24 tháng. Đánh giá tình trạng khối u được thực hiện mỗi 9 tuần. Đánh giá kết quả về hiệu quả chính là thời gian sống còn toàn bộ và thời gian sống còn không tiến triển bệnh như được đánh giá bởi nhà nghiên cứu theo RECIST phiên bản 1.1. Đánh giá kết quả về hiệu quả phụ là tỷ lệ đáp ứng toàn bộ (ORR) và thời gian đáp ứng, theo RECIST phiên bản 1.1, như được đánh giá bởi nhà nghiên cứu.
Các đặc điểm ban đầu của những bệnh nhân này là: tuổi trung vị là 63 tuổi (khoảng: 27-94), 43% từ 65 tuổi trở lên; 83% là nam giới; 37% là người da trắng và 53% là người châu Á; 40% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 và 60% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 1. 91% bệnh nhân bị bệnh giai đoạn M1 và 9% bệnh nhân bị bệnh giai đoạn M0. 73% bệnh nhân có mô học khối u là ung thư biểu mô tế bào vảy và 27% bệnh nhân có mô học khối u là ung thư biểu mô tuyến.
KEYTRUDA, kết hợp với hóa trị liệu, đã cho thấy sự cải thiện có ý nghĩa thống kê và có ý nghĩa lâm sàng về thời gian sống còn toàn bộ và thời gian sống còn không tiến triển bệnh khi so với hóa trị liệu (cisplatin và 5-FU) ở những người tham gia bị ung thư biểu mô thực quản hoặc chỗ nối dạ dày-thực quản tiến triển tại chỗ không thể cắt bỏ hoặc di căn chưa được điều trị trước đây. Các kết quả do nhà nghiên cứu đánh giá phù hợp với Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR).
Bảng 29 tóm tắt các đánh giá về hiệu quả chính của nghiên cứu KEYNOTE-590. Đường cong Kaplan-Meier về thời gian sống còn toàn bộ và thời gian sống còn không tiến triển bệnh được thể hiện trong
Hình 18 và
19.
- xem Bảng 29

- xem Hình 18 và 19
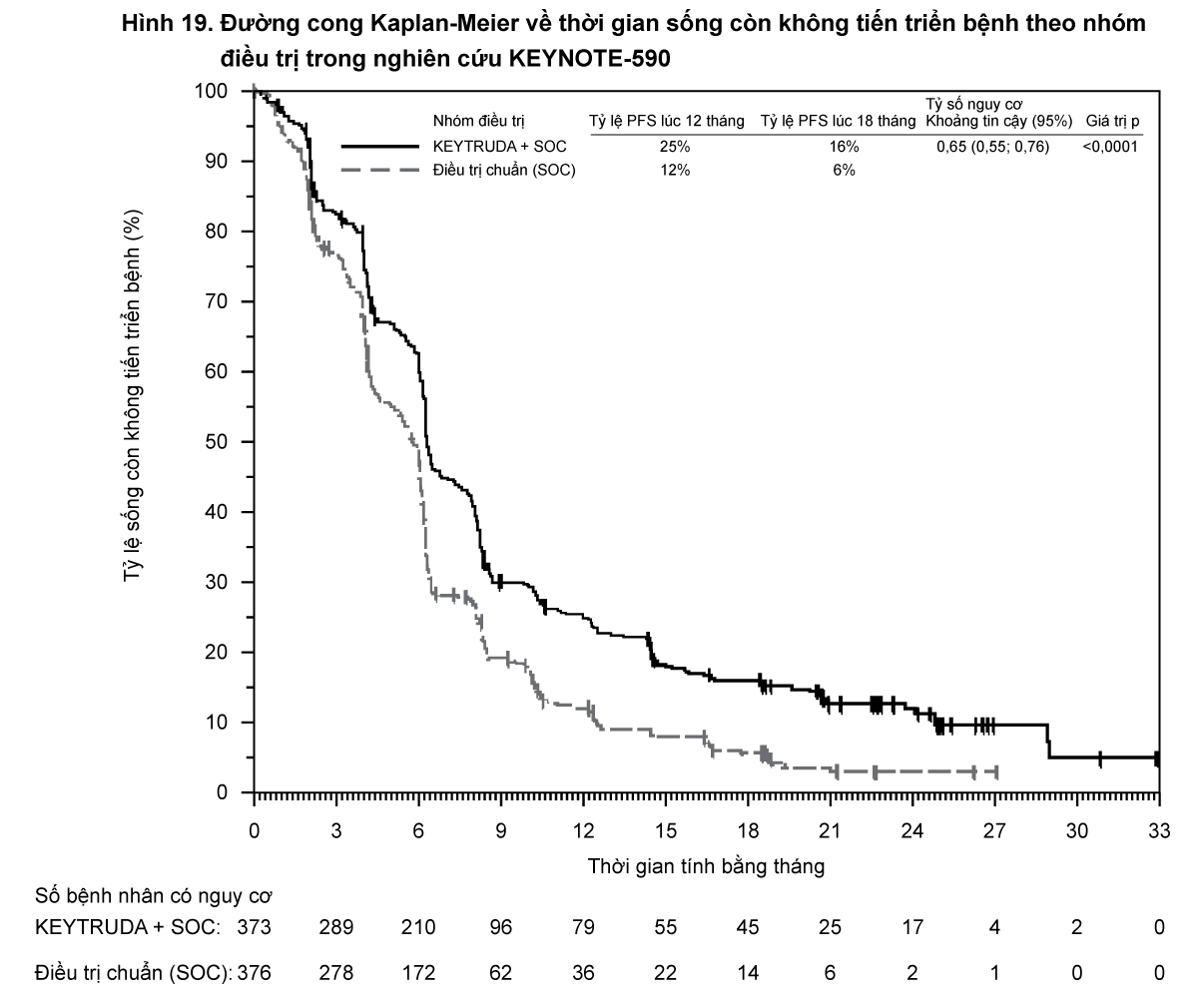 Ung thư thực quản tái phát tiến triển tại chỗ hoặc di căn đã được điều trị trước đây
Ung thư thực quản tái phát tiến triển tại chỗ hoặc di căn đã được điều trị trước đây
KEYNOTE-181
Hiệu quả của KEYTRUDA đã được khảo sát trong nghiên cứu KEYNOTE-181 (NCT02564263) là một thử nghiệm đa trung tâm, ngẫu nhiên, nhãn mở, đối chứng với hoạt chất đưa vào nghiên cứu 628 bệnh nhân bị ung thư thực quản tái phát tiến triển tại chỗ hoặc di căn với bệnh tiến triển khi đang dùng hoặc sau 1 bước điều trị toàn thân trước đó đối với bệnh tiến triển. Những bệnh nhân ung thư thực quản có HER2/neu dương tính cần phải được điều trị bằng liệu pháp nhắm đích HER2/neu đã được phê duyệt. Tất cả bệnh nhân cần phải có mẫu khối u để xét nghiệm PD-L1 tại phòng xét nghiệm trung tâm; tình trạng PD-L1 được xác định bằng cách sử dụng PD-L1 IHC 22C3 pharmDx
TM kit. Những bệnh nhân có tiền sử viêm phổi không do nhiễm khuẩn cần phải dùng steroid hoặc hiện đang bị viêm phổi, bệnh tự miễn hoạt động, hoặc một tình trạng y khoa đòi hỏi phải điều trị ức chế miễn dịch là không đủ điều kiện.
Các bệnh nhân được phân ngẫu nhiên (1:1) dùng KEYTRUDA 200 mg mỗi 3 tuần hoặc theo lựa chọn của nhà nghiên cứu về bất kỳ phác đồ hóa trị liệu nào sau đây, tất cả được dùng tiêm truyền tĩnh mạch: paclitaxel 80-100 mg/m
2 vào ngày thứ 1, 8, và 15 của mỗi chu kỳ 4 tuần, docetaxel 75 mg/m
2 mỗi 3 tuần, hoặc irinotecan 180 mg/m
2 mỗi 2 tuần. Sự chọn ngẫu nhiên được phân tầng theo mô học của khối u (ung thư biểu mô tế bào vảy thực quản [ESCC] so với ung thư biểu mô tuyến thực quản [EAC]/ung thư biểu mô tuyến thực quản ở chỗ nối dạ dày-thực quản [GEJ]) type I theo phân loại của Siewert, và theo vùng địa lý (châu Á so với ngoài châu Á). Điều trị bằng KEYTRUDA hoặc hóa trị liệu tiếp tục cho đến khi độc tính không thể chấp nhận được hoặc tiến triển bệnh. Các bệnh nhân được chọn ngẫu nhiên dùng KEYTRUDA có thể tiếp tục điều trị sau khi tiến triển bệnh được xác định theo RECIST phiên bản 1.1 đầu tiên (được sửa đổi để theo dõi tối đa 10 tổn thương đích và tối đa 5 tổn thương đích mỗi cơ quan) nếu bệnh nhân đã ổn định về lâm sàng cho đến khi bằng chứng trên phim X-quang đầu tiên về tiến triển bệnh được xác nhận ít nhất 4 tuần sau đó bằng chụp hình ảnh lặp lại. Những bệnh nhân điều trị bằng KEYTRUDA không có tiến triển bệnh có thể được điều trị đến 24 tháng. Đánh giá tình trạng khối u được thực hiện mỗi 9 tuần. Đánh giá kết quả về hiệu quả chính là thời gian sống còn toàn bộ được đánh giá ở các nhóm bệnh nhân theo đồng tiêu chí chính sau đây: bệnh nhân ung thư biểu mô tế bào vảy thực quản (ESCC), bệnh nhân có khối u biểu hiện PD-L1 với CPS ≥ 10, và tất cả bệnh nhân được chọn ngẫu nhiên. Đánh giá kết quả về hiệu quả bổ sung là thời gian sống còn không tiến triển bệnh (PFS), tỷ lệ đáp ứng toàn bộ (ORR) và thời gian đáp ứng (DoR), theo tiêu chuẩn đánh giá đáp ứng về khối u đặc (RECIST) phiên bản 1.1, được sửa đổi để theo dõi tối đa 10 tổn thương đích và tối đa 5 tổn thương đích mỗi cơ quan, như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR).
Tổng cộng có 628 bệnh nhân được đưa vào nghiên cứu và được chọn ngẫu nhiên dùng KEYTRUDA (n=314) hoặc theo lựa chọn điều trị của nhà nghiên cứu (n=314). Trong số 628 bệnh nhân này, 167 bệnh nhân (27%) bị ung thư biểu mô tế bào vảy thực quản có biểu hiện PD-L1 với CPS ≥ 10. Trong số 167 bệnh nhân này, 85 bệnh nhân được chọn ngẫu nhiên dùng KEYTRUDA và 82 bệnh nhân theo lựa chọn điều trị của nhà nghiên cứu [paclitaxel (n=50), docetaxel (n=19), hoặc irinotecan (n=13)]. Các đặc điểm ban đầu của những bệnh nhân này là: tuổi trung vị là 65 tuổi (khoảng: 33-80), 51% từ 65 tuổi trở lên; 84% là nam giới; 32% là người da trắng và 68% là người châu Á; 38% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 và 62% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 1. 90% bệnh nhân bị bệnh giai đoạn M1 và 10% bệnh nhân bị bệnh giai đoạn M0. Trước khi được đưa vào nghiên cứu, 99% bệnh nhân đã được điều trị dựa trên platin và 84% bệnh nhân cũng đã được điều trị bằng fluoropyrimidine. 33% bệnh nhân đã được điều trị trước đó bằng taxane.
Tỷ số nguy cơ của thời gian sống còn toàn bộ đã được quan sát thấy là 0,77 (khoảng tin cậy 95%: 0,63, 0,96) ở những bệnh nhân ung thư biểu mô tế bào vảy thực quản (ESCC), 0,70 (khoảng tin cậy 95%: 0,52, 0,94) ở bệnh nhân có khối u biểu hiện PD-L1 với CPS ≥ 10, và 0,89 (khoảng tin cậy 95%: 0,75, 1,05) ở tất cả bệnh nhân được chọn ngẫu nhiên. Khi khảo sát thêm ở những bệnh nhân có khối u ESCC có biểu hiện PD-L1 (CPS ≥ 10), đã quan sát thấy sự cải thiện về thời gian sống còn toàn bộ ở những bệnh nhân được chọn ngẫu nhiên dùng KEYTRUDA khi so với hóa trị liệu.
Bảng 30 và
Hình 20 tóm tắt các đánh giá về hiệu quả chính về nghiên cứu KEYNOTE-181 đối với những bệnh nhân ung thư biểu mô tế bào vảy thực quản có CPS ≥ 10.
- xem Bảng 30

- xem Hình 20
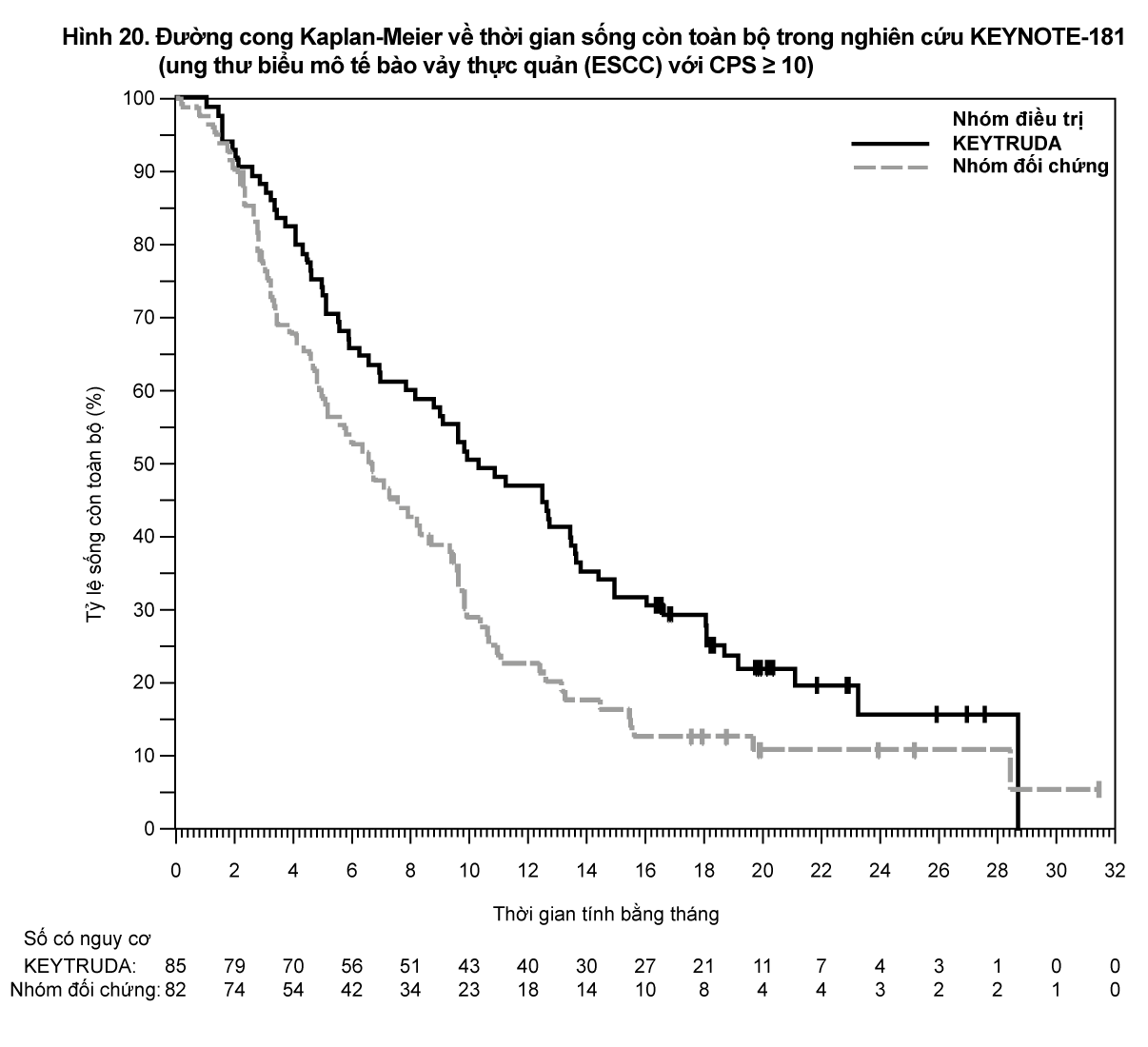 KEYNOTE-180
KEYNOTE-180
Hiệu quả của KEYTRUDA đã được khảo sát trong nghiên cứu KEYNOTE-180 (NCT02559687) là một thử nghiệm đa trung tâm, không ngẫu nhiên, nhãn mở đưa vào nghiên cứu 121 bệnh nhân ung thư thực quản tiến triển tại chỗ hoặc di căn với bệnh tiến triển khi đang dùng hoặc sau ít nhất 2 bước điều trị toàn thân trước đó đối với bệnh tiến triển. Ngoại trừ số bước điều trị trước đó, các tiêu chuẩn đủ điều kiện là tương tự và phác đồ dùng thuốc giống hệt với nghiên cứu KEYNOTE-181.
Đánh giá kết quả về hiệu quả chính là tỷ lệ đáp ứng toàn bộ (ORR) và thời gian đáp ứng (DoR), theo tiêu chuẩn đánh giá đáp ứng về khối u đặc (RECIST) phiên bản 1.1, được sửa đổi để theo dõi tối đa 10 tổn thương đích và tối đa 5 tổn thương đích mỗi cơ quan, như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR).
Trong số 121 bệnh nhân được đưa vào nghiên cứu, 29% bệnh nhân (n=35) ung thư biểu mô tế bào vảy thực quản (ESCC) có biểu hiện PD-L1 với CPS ≥ 10. Các đặc điểm ban đầu của 35 bệnh nhân này là: tuổi trung vị là 65 tuổi (khoảng: 47-81), 51% từ 65 tuổi trở lên; 71% là nam giới; 26% là người da trắng và 69% là người châu Á; 40% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 và 60% có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 1. 100% bệnh nhân bị bệnh giai đoạn M1.
Tỷ lệ đáp ứng toàn bộ (ORR) ở 35 bệnh nhân ung thư biểu mô tế bào vảy thực quản có biểu hiện PD-L1 là 20% (khoảng tin cậy 95%: 8, 37). Trong số 7 bệnh nhân đáp ứng, thời gian đáp ứng trong khoảng từ 4,2 đến 25,1
+ tháng, với 5 bệnh nhân (71%) có đáp ứng 6 tháng hoặc lâu hơn và 3 bệnh nhân (57%) có đáp ứng 12 tháng hoặc lâu hơn.
Nhóm bệnh nhân trẻ em
Hiệu quả đối với các bệnh nhân trẻ em bị u lympho Hodgkin kinh điển (cHL), u lympho tế bào B lớn trung thất nguyên phát (PMBCL) hoặc ung thư mất ổn định vi vệ tinh mức độ cao (MSI-H) được ngoại suy từ kết quả ở các nhóm bệnh nhân người lớn tương ứng.
UNG THƯ VÚ BỘ BA ÂM TÍNH
KEYNOTE-522: Nghiên cứu có đối chứng về điều trị tân bổ trợ và điều trị bổ trợ cho bệnh nhân ung thư vú bộ ba âm tính giai đoạn sớm có nguy cơ cao
Hiệu quả của KEYTRUDA kết hợp với carboplatin và paclitaxel, tiếp theo là doxorubicin hoặc epirubicin và cyclophosphamide, được dùng dưới dạng điều trị tân bổ trợ và tiếp tục dưới dạng điều trị bổ trợ đơn trị liệu đã được khảo sát trong nghiên cứu KEYNOTE-522, một nghiên cứu ngẫu nhiên, mù đôi, đa trung tâm, đối chứng với giả dược. Các tiêu chuẩn đủ điều kiện chính để tham gia nghiên cứu này là ung thư vú bộ ba âm tính giai đoạn sớm có nguy cơ cao mới được chẩn đoán, chưa được điều trị trước đó (kích thước khối u đường kính > 1 cm nhưng ≤ 2 cm có liên quan đến hạch bạch huyết hoặc kích thước khối u đường kính > 2 cm bất kể sự liên quan đến hạch bạch huyết), bất kể khối u biểu hiện PD-L1. Những bệnh nhân bị bệnh tự miễn hoạt động cần phải điều trị toàn thân trong vòng 2 năm hoặc một tình trạng y khoa cần phải điều trị ức chế miễn dịch là không đủ điều kiện tham gia nghiên cứu. Việc chọn ngẫu nhiên được phân tầng theo tình trạng hạch bạch huyết (dương tính so với âm tính), kích thước khối u (T1/T2 so với T3/T4) và lựa chọn carboplatin (dùng liều mỗi 3 tuần so với mỗi tuần).
Các bệnh nhân được phân ngẫu nhiên (2:1) vào một trong các nhóm điều trị sau; tất cả các thuốc nghiên cứu được dùng qua tiêm truyền tĩnh mạch.
• Nhóm 1:
- 4 chu kỳ sử dụng KEYTRUDA 200 mg trước phẫu thuật mỗi 3 tuần vào ngày thứ 1 của chu kỳ 1-4 của phác đồ điều trị kết hợp với:
+ Carboplatin: AUC 5 mg/mL/phút mỗi 3 tuần vào ngày thứ 1 của chu kỳ 1-4 của phác đồ điều trịhoặc AUC 1,5 mg/mL/phút mỗi tuần vào ngày thứ 1, 8 và 15 của chu kỳ 1-4 của phác đồ điều trị và
+ Paclitaxel: 80 mg/m
2 mỗi tuần vào ngày thứ 1, 8 và 15 của chu kỳ 1-4 của phác đồ điều trị
- Tiếp theo là 4 chu kỳ bổ sung KEYTRUDA 200 mg trước phẫu thuật mỗi 3 tuần vào ngày thứ 1 của chu kỳ 5-8 của phác đồ điều trị kết hợp với:
+ Doxorubicin 60 mg/m
2 hoặc epirubicin 90 mg/m
2 mỗi 3 tuần vào ngày thứ 1 của chu kỳ 5-8 của phác đồ điều trị và
+ Cyclophosphamide 600 mg/m
2 mỗi 3 tuần vào ngày thứ 1 của chu kỳ 5-8 của phác đồ điều trị
- Sau phẫu thuật, sử dụng 9 chu kỳ KEYTRUDA 200 mg mỗi 3 tuần.
• Nhóm 2:
- 4 chu kỳ giả dược trước phẫu thuật mỗi 3 tuần vào ngày thứ 1 của chu kỳ 1-4 của phác đồ điều trị kết hợp với:
+ Carboplatin: AUC 5 mg/mL/phút mỗi 3 tuần vào ngày thứ 1 của chu kỳ 1-4 của phác đồ điều trị hoặc AUC 1,5 mg/mL/phút mỗi tuần vào ngày thứ 1, 8 và 15 của chu kỳ 1-4 của phác đồ điều trị và
+ Paclitaxel 80 mg/m
2 mỗi tuần vào ngày thứ 1, 8 và 15 của chu kỳ 1-4 của phác đồ điều trị
- Tiếp theo là 4 chu kỳ bổ sung giả dược trước phẫu thuật mỗi 3 tuần vào ngày thứ 1 của chu kỳ 5-8 của phác đồ điều trị kết hợp với:
+ Doxorubicin 60 mg/m
2 hoặc epirubicin 90 mg/m
2 mỗi 3 tuần vào ngày thứ 1 của chu kỳ 5-8 của phác đồ điều trị và
+ Cyclophosphamide 600 mg/m
2 mỗi 3 tuần vào ngày thứ 1 của chu kỳ 5-8 của phác đồ điều trị
- Sau phẫu thuật, sử dụng 9 chu kỳ giả dược mỗi 3 tuần.
Tiếp tục điều trị bằng KEYTRUDA hoặc giả dược cho đến khi hoàn thành điều trị (17 chu kỳ), tiến triển bệnh trước phẫu thuật triệt căn, tái phát bệnh trong giai đoạn bổ trợ, hoặc độc tính không thể chấp nhận được.
Đánh giá kết quả về hiệu quả chính là tỷ lệ đáp ứng hoàn toàn về mặt giải phẫu bệnh (pCR) và thời gian sống còn không có biến cố (EFS). Đáp ứng hoàn toàn về giải phẫu bệnh được định nghĩa là không có ung thư xâm lấn ở vú và các hạch bạch huyết (ypT0/Tis ypN0) và được đánh giá bởi bác sĩ giải phẫu bệnh của địa phương theo phương pháp mù tại thời điểm phẫu thuật triệt căn. Thời gian sống còn không có biến cố được định nghĩa là thời gian từ khi chọn ngẫu nhiên đến khi xuất hiện lần đầu tiên bất kỳ biến cố nào sau đây: tiến triển bệnh trước phẫu thuật triệt căn, tái phát tại chỗ hoặc xa, bệnh ác tính nguyên phát thứ hai hoặc tử vong do mọi nguyên nhân. Đánh giá kết quả về hiệu quả bổ sung là thời gian sống còn toàn bộ.
Tổng cộng có 1.174 bệnh nhân được chọn ngẫu nhiên: 784 bệnh nhân vào nhóm dùng KEYTRUDA và 390 bệnh nhân vào nhóm dùng giả dược. Các đặc điểm của nhóm bệnh nhân nghiên cứu là: tuổi trung vị là 49 tuổi (khoảng: 22-80), 11% từ 65 tuổi trở lên; 99,9% là nữ giới; 64% là người da trắng, 20% là người châu Á, 5% là người da đen và 2% là người da đỏ Mỹ hoặc thổ dân Alaska; 87% bệnh nhân có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 và 13% bệnh nhân có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 1; 56% bệnh nhân ở tình trạng tiền mãn kinh và 44% bệnh nhân ở tình trạng sau mãn kinh; 7% bệnh nhân có khối u nguyên phát giai đoạn 1 (T1), 68% T2, 19% T3 và 7% T4; 49% bệnh nhân có liên quan đến hạch bạch huyết giai đoạn 0 (N0), 40% N1, 11% N2 và 0,2% N3; 75% bệnh nhân ở giai đoạn II toàn bộ và 25% bệnh nhân ở giai đoạn III.
Thử nghiệm đã cho thấy sự cải thiện có ý nghĩa thống kê về pCR và EFS tại một phân tích được xác định trước đối với những bệnh nhân được phân ngẫu nhiên dùng KEYTRUDA kết hợp với hóa trị liệu, tiếp theo là KEYTRUDA đơn trị liệu so với những bệnh nhân được phân ngẫu nhiên dùng giả dược kết hợp với hóa trị liệu, tiếp theo là giả dược đơn độc. Tại thời điểm phân tích EFS, kết quả về thời gian sống còn toàn bộ (OS) chưa hoàn thiện (45% các biến cố cần thiết cho phân tích cuối cùng). Tuy nhiên, dữ liệu đã cho thấy sự cải thiện về OS ưu thế ở nhóm dùng KEYTRUDA hơn nhóm dùng giả dược. Tại một phân tích giữa kỳ được xác định trước, thời gian theo dõi trung vị đối với 784 bệnh nhân được điều trị bằng KEYTRUDA là 37,8 tháng (khoảng: 2,7-48 tháng). Kết quả về hiệu quả được tóm tắt trong
Bảng 31 và
Hình 21.
- xem Bảng 31

- xem Hình 21
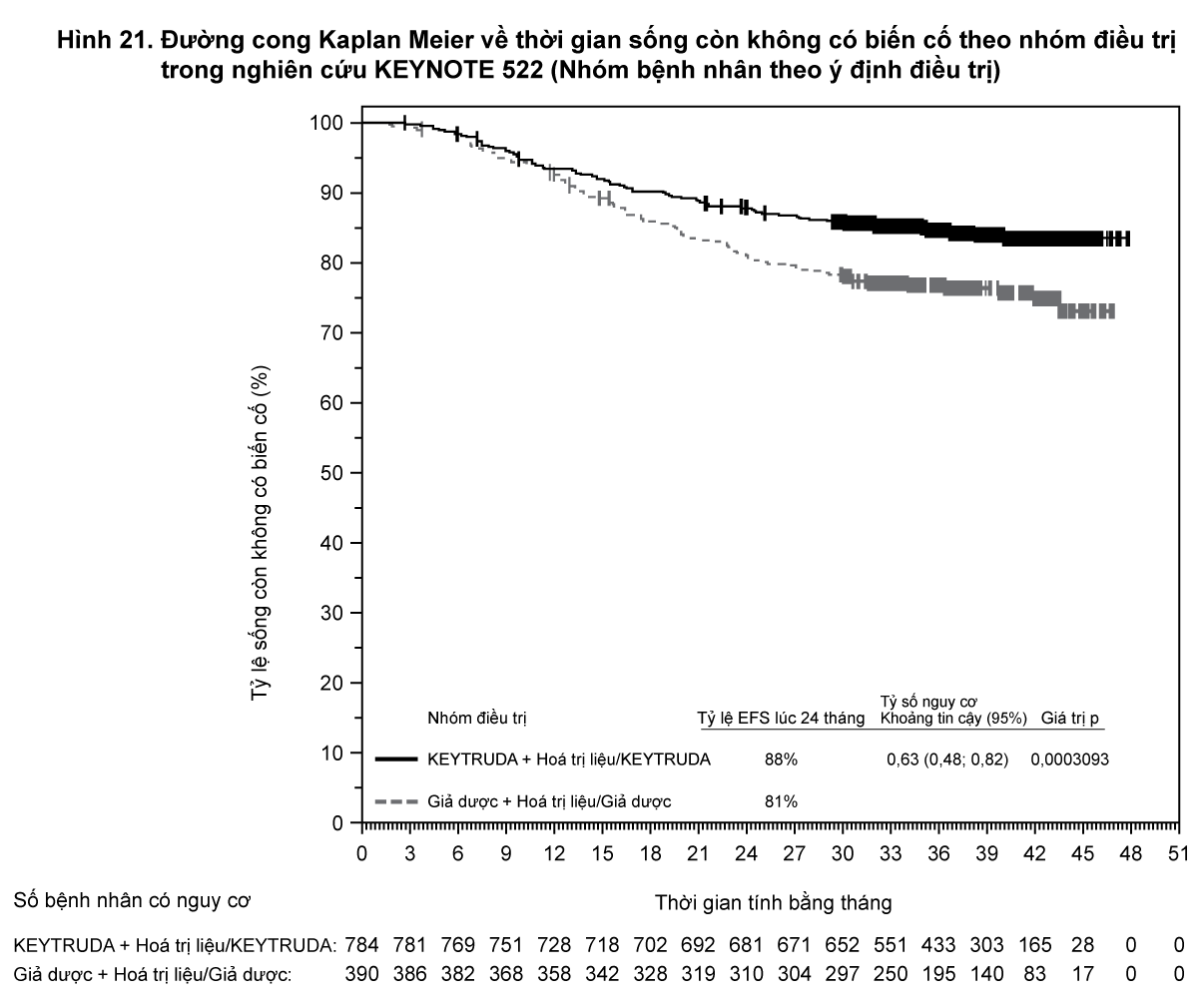
Ảnh hưởng của việc bổ sung KEYTRUDA vào hóa trị liệu đối với chất lượng cuộc sống liên quan đến sức khỏe đã được đánh giá bằng cách sử dụng EORTC QLQ-C30 (Bảng câu hỏi đánh giá chất lượng cuộc sống của bệnh nhân ung thư của Tổ chức Nghiên cứu và điều trị ung thư châu Âu). Sau 21 tuần theo dõi, điểm số giá trị trung bình bình phương tối thiểu (LS) thay đổi theo thang điểm về tình trạng sức khỏe chung/chất lượng cuộc sống QLQ-C30 là -11,24 (-12,82, -9,66) ở những bệnh nhân được điều trị bằng KEYTRUDA kết hợp với hóa trị liệu và -10,20 (-12,30, -8,10) ở những bệnh nhân được điều trị bằng giả dược kết hợp với hóa trị liệu dưới dạng điều trị tân bổ trợ [sự khác biệt về giá trị trung bình bình phương tối thiểu: -1,04; khoảng tin cậy 95%: -3,46, 1,38]. Sau 24 tuần theo dõi, điểm số giá trị trung bình bình phương tối thiểu thay đổi theo thang điểm về tình trạng sức khỏe chung/chất lượng cuộc sống là 2,47 (1,05, 3,88) ở những bệnh nhân được điều trị bằng KEYTRUDA và 2,88 (1,05, 4,71) ở những bệnh nhân được điều trị bằng giả dược dưới dạng điều trị bổ trợ [sự khác biệt về giá trị trung bình bình phương tối thiểu: -0,41 (-2,60, 1,77)].
KEYNOTE 355: Nghiên cứu có đối chứng về liệu pháp phối hợp ở bệnh nhân ung thư vú bộ ba âm tính tái phát tại chỗ không thể cắt bỏ hoặc di căn
Hiệu quả của KEYTRUDA kết hợp với paclitaxel, nab-paclitaxel, hoặc gemcitabine và carboplatin đã được khảo sát trong nghiên cứu KEYNOTE-355, một nghiên cứu ngẫu nhiên, mù đôi, đa trung tâm, đối chứng với giả dược. Các tiêu chuẩn đủ điều kiện chính để tham gia nghiên cứu này là ung thư vú bộ ba âm tính tái phát tại chỗ không thể cắt bỏ hoặc di căn, bất kể khối u biểu hiện PD-L1 và chưa được điều trị bằng hóa trị liệu trước đó. Những bệnh nhân mắc bệnh tự miễn hoạt động cần phải điều trị toàn thân trong vòng 2 năm hoặc một tình trạng y khoa cần phải điều trị ức chế miễn dịch là không đủ điều kiện tham gia nghiên cứu. Việc chọn ngẫu nhiên được phân tầng bằng điều trị hóa trị liệu (paclitaxel hoặc nab-paclitaxel so với gemcitabine và carboplatin), khối u biểu hiện PD-L1 (CPS ≥ 1 so với CPS < 1) dựa trên bộ kit PD-L1 IHC 22C3 pharmDx
TM, và điều trị trước với cùng nhóm hóa trị liệu trong bối cảnh tân bổ trợ (Có so với Không).
Các bệnh nhân được phân ngẫu nhiên (2:1) vào một trong các nhóm điều trị sau; tất cả các thuốc nghiên cứu được dùng qua tiêm truyền tĩnh mạch.
• KEYTRUDA 200 mg vào ngày thứ 1 mỗi 3 tuần kết hợp với nab-paclitaxel 100 mg/m
2 vào ngày thứ 1, 8 và 15 mỗi 28 ngày, hoặc paclitaxel 90 mg/m
2 vào ngày thứ 1, 8, và 15 mỗi 28 ngày, hoặc gemcitabine 1.000 mg/m
2 và carboplatin AUC 2 mg/mL/phút vào ngày thứ 1 và 8 mỗi 21 ngày.
• Giả dược vào ngày thứ 1 mỗi 3 tuần kết hợp với nab-paclitaxel 100 mg/m
2 vào ngày thứ 1, 8 và 15 mỗi 28 ngày, hoặc paclitaxel 90 mg/m
2 vào ngày thứ 1, 8, và 15 mỗi 28 ngày, hoặc gemcitabine 1.000 mg/m
2 và carboplatin AUC 2 mg/mL/phút vào ngày thứ 1 và 8 mỗi 21 ngày.
Tiếp tục điều trị bằng KEYTRUDA hoặc giả dược cho đến khi tiến triển bệnh được xác định theo tiêu chuẩn đánh giá đáp ứng về khối u đặc (RECIST) phiên bản 1.1 như được xác định bởi nhà nghiên cứu, độc tính không thể chấp nhận được hoặc tối đa 24 tháng. Việc điều trị có thể tiếp tục sau khi tiến triển bệnh được xác định theo RECIST nếu bệnh nhân ổn định trên lâm sàng và được các nhà nghiên cứu xem là có lợi ích lâm sàng. Đánh giá tình trạng khối u được thực hiện ở tuần thứ 8, 16 và 24, sau đó mỗi 9 tuần trong năm đầu tiên và mỗi 12 tuần sau đó.
Đánh giá kết quả về hiệu quả chính là thời gian sống còn không tiến triển bệnh ở những bệnh nhân có khối u biểu hiện PD-L1 CPS ≥ 10, như được đánh giá bởi Ủy ban xem xét trung ương độc lập, mù với phân bổ điều trị (BICR) sử dụng RECIST 1.1. Đánh giá kết quả về hiệu quả bổ sung là tỷ lệ đáp ứng khách quan (ORR), thời gian đáp ứng (DOR) và tỷ lệ kiểm soát bệnh (DCR) (bệnh ổn định trong ít nhất 24 tuần, hoặc đáp ứng hoàn toàn, hoặc đáp ứng một phần) ở những bệnh nhân có khối u biểu hiện PD-L1 CPS ≥ 10 như được đánh giá bởi BICR sử dụng RECIST 1.1.
Tổng cộng có 847 bệnh nhân được phân ngẫu nhiên: 566 bệnh nhân vào nhóm dùng KEYTRUDA và 281 bệnh nhân vào nhóm dùng giả dược. Các đặc điểm của nhóm bệnh nhân nghiên cứu là: tuổi trung vị là 53 tuổi (khoảng: 22-85), 21% từ 65 tuổi trở lên; 100% là nữ giới; 68% là người da trắng, 21% là người châu Á và 4% là người da đen; 60% bệnh nhân có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 0 và 40% bệnh nhân có điểm số tình trạng hoạt động cơ thể theo thang điểm ECOG là 1 và 68% bệnh nhân ở tình trạng sau mãn kinh. 75% bệnh nhân có khối u biểu hiện PD-L1 được xác định là CPS ≥ 1 và 38% bệnh nhân có khối u biểu hiện PD-L1 CPS ≥ 10.
Trong nghiên cứu KEYNOTE-355, có sự cải thiện có ý nghĩa thống kê về PFS ở những bệnh nhân có khối u biểu hiện PD-L1 CPS ≥ 10 được chọn ngẫu nhiên dùng KEYTRUDA kết hợp với paclitaxel, nab-paclitaxel, hoặc gemcitabine và carboplatin so với những bệnh nhân được chọn ngẫu nhiên dùng giả dược kết hợp với paclitaxel, nab-paclitaxel, hoặc gemcitabine và carboplatin. Thử nghiệm cũng cho thấy sự cải thiện có ý nghĩa lâm sàng về ORR và DOR.Kết quả về hiệu quả được tóm tắt trong
Bảng 32 và
Hình 22.
- xem Bảng 32

- xem Hình 22
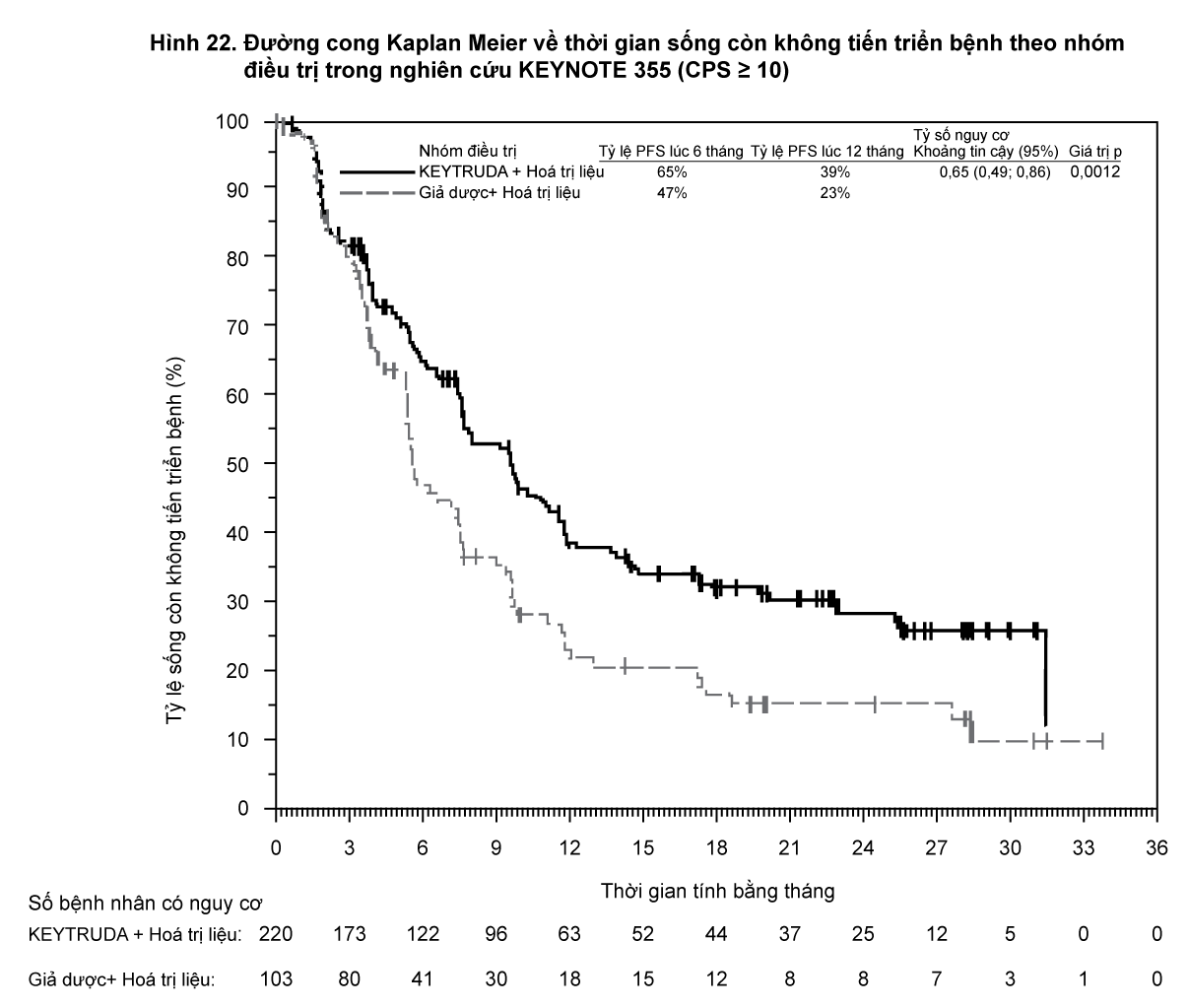
Ảnh hưởng của việc bổ sung KEYTRUDA vào hóa trị liệu đối với kết quả do bệnh nhân báo cáo đã được đánh giá bằng cách sử dụng EORTC QLQ-C30, EORTC QLQ-BR23 và EuroQol EQ-5D. Kết quả từ mỗi đánh giá đã cho thấy việc bổ sung KEYTRUDA vào hóa trị liệu đã không dẫn đến giảm chất lượng cuộc sống liên quan đến sức khỏe trong suốt 15 tuần theo dõi.
Tính sinh miễn dịch
Trong các nghiên cứu lâm sàng ở những bệnh nhân được điều trị bằng pembrolizumab với liều 2 mg/kg mỗi 3 tuần, 200 mg mỗi 3 tuần, hoặc 10 mg/kg 2 hoặc 3 tuần, 36 bệnh nhân (1,8%) trong số 2034 bệnh nhân có thể đánh giá đã được thử nghiệm dương tính với kháng thể kháng pembrolizumab xuất hiện trong khi điều trị, trong đó 9 bệnh nhân (0,4%) có kháng thể trung hòa kháng pembrolizumab. Không có bằng chứng về hồ sơ dược động học thay đổi hoặc hồ sơ về an toàn với sự phát triển kháng thể gắn kết kháng pembrolizumab hoặc kháng thể trung hòa.




 Đăng xuất
Đăng xuất