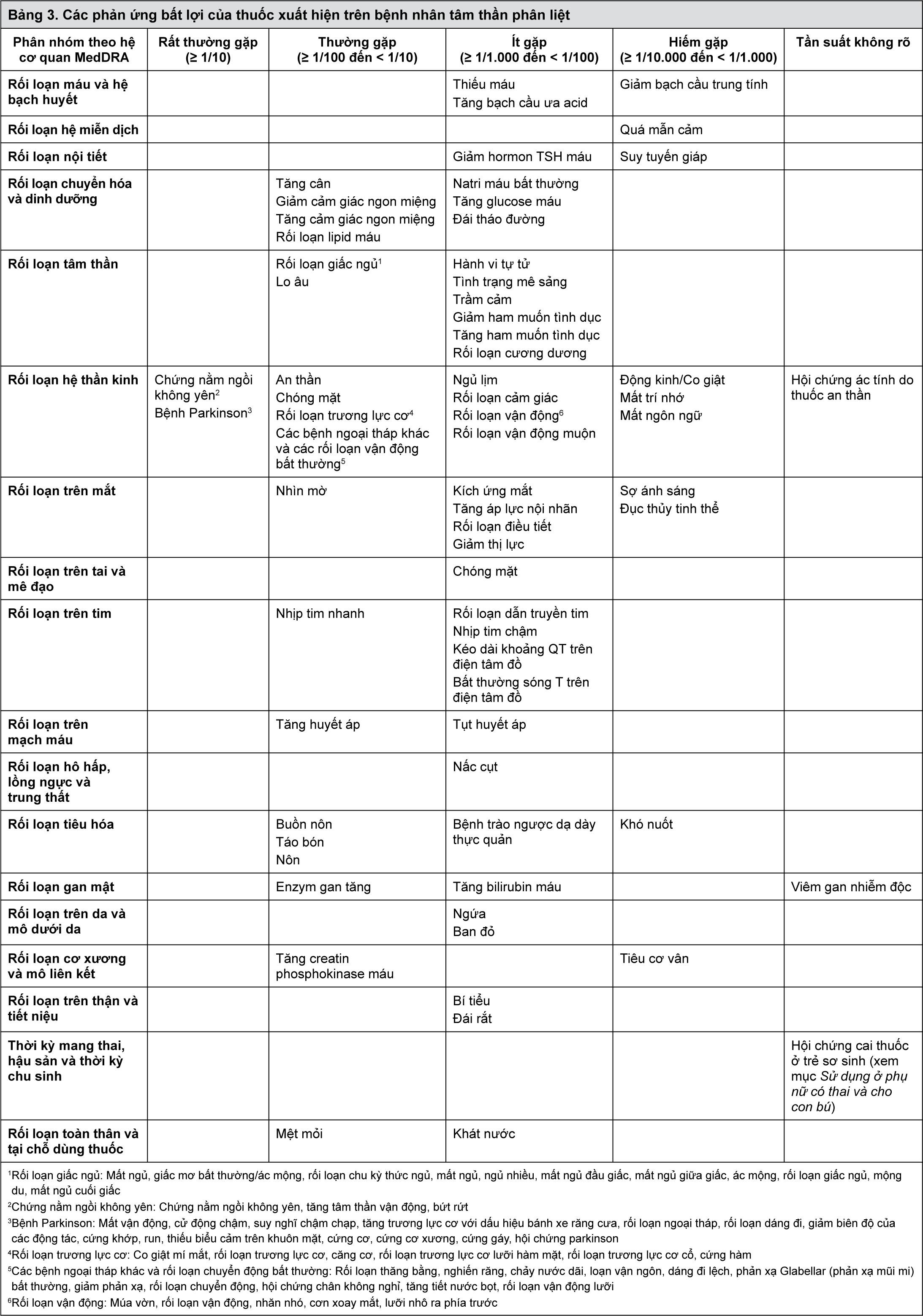
Đặc tính dược lực học
Nhóm dược lý điều trị: Thuốc tâm thần kinh, các thuốc chống loạn thần khác, mã ATC: N05AX15.
Cơ chế tác dụng
Cơ chế tác dụng của cariprazin chưa được biết đầy đủ. Tuy nhiên, tác dụng điều trị của cariprazin là thông qua sự kết hợp hoạt tính chủ vận một phần trên thụ thể dopamin D
3, D
2 (giá trị Ki tương ứng là 0,085-0,3 nM so với 0,49-0,71 nM) và trên thụ thể serotonin 5 HT
1A (giá trị Ki là 1,4-2,6 nM), và hoạt tính đối kháng trên thụ thể serotonin 5 HT
2B, 5 HT
2A và thụ thể histamin H
1 (giá trị Ki tương ứng là 0,58-1,1 nM, 18,8 nM và 23,3 nM). Cariprazin có ái lực thấp với thụ thể serotonin 5 HT
2C và thụ thể adrenergic 1 (giá trị Ki tương ứng là 134 nM và 155 nM). Cariprazin không có ái lực đáng kể với thụ thể cholinergic muscarinic (IC
50 > 1.000 nM). Hai chất chuyển hóa chính có hoạt tính, desmethyl cariprazin và didesmethyl cariprazin có khả năng liên kết với thụ thể in vitro và hoạt tính tương tự cariprazin.
Đặc tính dược lực học
Các nghiên cứu tiền lâm sàng
in vivo cho thấy cariprazin gắn vào thụ thể D
3 ở mức độ tương tự với thụ thể D
2 ở các mức liều có tác dụng dược lý. Sự gắn kết với thụ thể dopamin D
3 và D
2 trên não phụ thuộc vào liều dùng (chiếm ưu thế ở vùng có thụ thể D
3 cao hơn) trên các bệnh nhân tâm thần phân liệt trong khoảng liều điều trị của cariprazin trong 15 ngày.
Ảnh hưởng của cariprazin trên khoảng QT được đánh giá trên bệnh nhân tâm thần phân liệt hoặc rối loạn phân liệt. Đánh giá điện tâm đồ Holter thu được trên 129 bệnh nhân trong suốt 12 giờ tại thời điểm ban đầu và ở trạng thái ổn định. Không phát hiện trường hợp nào có khoảng QT kéo dài sau khi dùng liều cao hơn mức liều điều trị (9 mg/ngày hoặc 18 mg/ngày). Không có bệnh nhân nào được điều trị bằng cariprazin có khoảng QTc tăng ≥ 60 ms (mili giây) so với trước điều trị, cũng không có bất cứ bệnh nhân nào có khoảng QTc > 500 ms trong nghiên cứu.
Hiệu quả lâm sàng
Hiệu quả khi sử dụng trong thời gian ngắn
Hiệu quả của cariprazin trong điều trị tâm thần phân liệt cấp tính đã được nghiên cứu trong 3 thử nghiệm lâm sàng đa trung tâm, đa quốc gia, ngẫu nhiên, mù đôi, có đối chứng giả dược trong 6 tuần bao gồm 1.754 bệnh nhân từ 18 đến 60 tuổi. Tiêu chí đánh giá chính là sự thay đổi tổng số điểm PANSS (thang đánh giá hội chứng dương tính và âm tính,
Positive and Negative Syndrome Scale) từ ban đầu cho đến tuần 6 và tiêu chí đánh giá phụ là sự thay đổi điểm CGI-S (Đánh giá tổng thể lâm sàng về mức độ nặng,
Clinical Global Impressions-Severity) từ ban đầu đến tuần 6 trong tất cả các nghiên cứu về tâm thần phân liệt cấp tính. Trong một nghiên cứu lâm sàng đa quốc gia có đối chứng giả dược sử dụng liều cố định 1,5 mg, 3,0 mg và 4,5 mg cariprazin và 4,0 mg risperidon để đánh giá về độ nhạy cảm, ở tất cả các mức liều của cariprazin và đối chứng có hoạt tính cho thấy sự cải thiện có ý nghĩa thống kê ở cả tiêu chí chính cũng như tiêu chí phụ so với nhóm dùng giả dược. Trong một nghiên cứu đa trung tâm khác có đối chứng giả dược sử dụng liều cố định 3,0 mg, 6,0 mg cariprazin và 10 mg aripiprazol để đánh giá độ nhạy cảm, cả 2 liều cariprazin và thuốc đối chứng có hoạt tính đều cho thấy sự cải thiện có ý nghĩa thống kê ở cả tiêu chí chính và tiêu chí phụ so với giả dược. Trong một nghiên cứu thứ ba, đa quốc gia, có đối chứng giả dược sử dụng liều cố định hoặc liều thay đổi 3,0-6,0 mg và 6,0-9,0 mg cariprazin, cả 2 nhóm liều cariprazin đều cho thấy sự cải thiện có ý nghĩa thống kê ở cả tiêu chí chính và tiêu chí phụ so với giả dược.
Kết quả thông số đánh giá chính được tóm tắt trong Bảng 1 dưới đây. Các kết quả về thông số đánh giá phụ (CGI) và các tiêu chí đánh giá bổ sung hỗ trợ cho tiêu chí chính.
- xem Bảng 1.
 Hiệu quả khi sử dụng lâu dài
Hiệu quả khi sử dụng lâu dài
Hiệu quả của cariprazin trong duy trì tác dụng chống loạn thần được nghiên cứu trong một thử nghiệm lâm sàng ngẫu nhiên dài ngày. Có tổng cộng 751 bệnh nhân có các triệu chứng tâm thần phân liệt cấp tính dùng 3-9 mg cariprazin/ngày trong 20 tuần, trong đó 337 bệnh nhân dùng cariprazin trong khoảng liều 3 hoặc 6 mg/ngày. Những bệnh nhân ổn định sau đó được phân nhóm ngẫu nhiên, mù đôi dùng liều cố định 3 hoặc 6 mg cariprazin (n=51) hoặc giả dược (n=51) cho tới 72 tuần. Tiêu chí đánh giá chính của nghiên cứu là thời gian tái phát. Kết thúc thử nghiệm, 49,0% bệnh nhân dùng giả dược so với 21,6% bệnh nhân dùng cariprazin có tái phát các triệu chứng tâm thần phân liệt. Do đó, thời gian tái phát (92 so với 326 ngày - dựa trên bách phân vị thứ 25) kéo dài rõ rệt hơn ở nhóm bệnh nhân dùng cariprazin so với nhóm dùng giả dược (p=0,009).
Hiệu quả trên các triệu chứng âm tính chủ yếu của bệnh tâm thần phân liệt
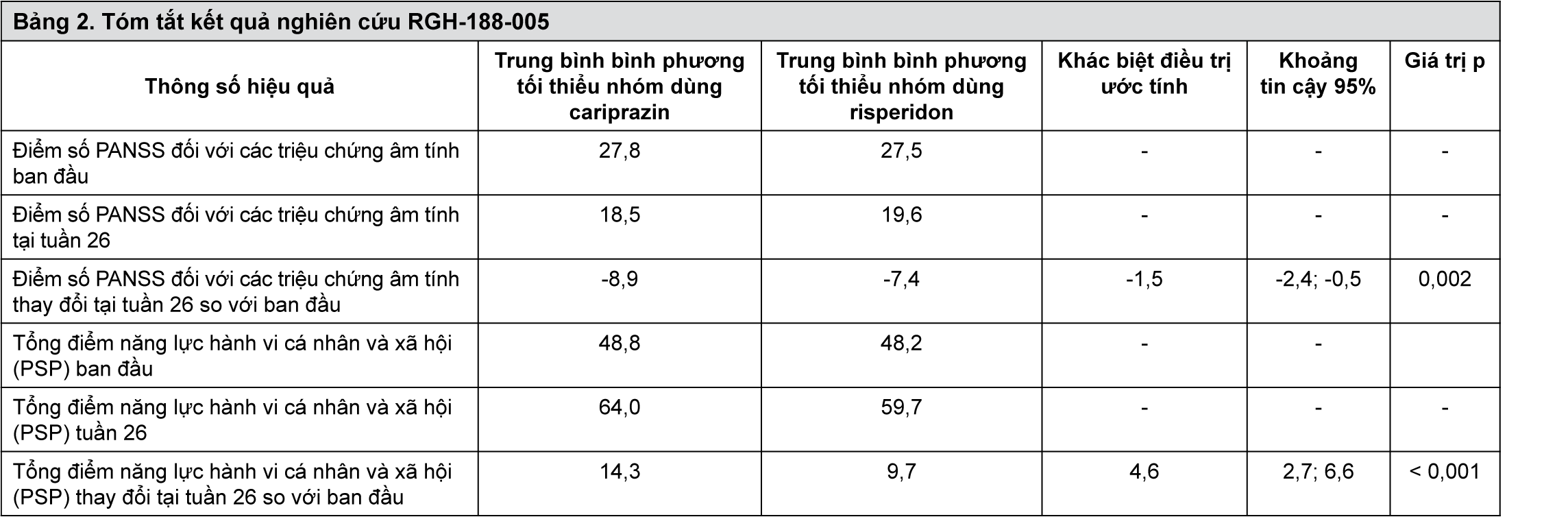
Hiệu quả của cariprazin trong điều trị các triệu chứng âm tính chủ yếu của bệnh tâm thần phân liệt được nghiên cứu trong một thử nghiệm lâm sàng đa trung tâm, mù đôi, đối chứng có hoạt tính trong vòng 26 tuần. Cariprazin (khoảng liều 3-6 mg, liều mục tiêu 4,5 mg) được nghiên cứu so với risperidon (khoảng liều 3-6 mg, liều mục tiêu 4 mg) trên bệnh nhân có các triệu chứng âm tính chủ yếu, dai dẳng của bệnh tâm thần phân liệt (n=461). 86% bệnh nhân dưới 55 tuổi, 54% bệnh nhân là nam giới.
Các triệu chứng âm tính chủ yếu, dai dẳng được định nghĩa là các triệu chứng kéo dài trong khoảng thời gian ít nhất 6 tháng với các triệu chứng âm tính ở mức độ cao và các triệu chứng dương tính ở mức độ thấp [(điểm số PANSS đối với các triệu chứng âm tính ≥ 24, điểm ≥ 4 cho ít nhất 2 trong 3 mục PANSS (N1: cảm xúc phẳng lặng, N4: thiếu động lực, và N6: nghèo nàn ngôn ngữ) và điểm số PANSS đối với các triệu chứng dương tính ≤ 19]. Các bệnh nhân có triệu chứng âm tính phụ, như các triệu chứng trầm cảm từ vừa đến nặng và bệnh Parkinson (EPS) biểu hiện trên lâm sàng bị loại trừ.
Cả hai nhóm bệnh nhân điều trị bằng cariprazin và risperidon đều cho thấy sự cải thiện có ý nghĩa thống kê các thông số về hiệu quả chính so với ban đầu, điểm số PANSS đối với các triệu chứng âm tính (PANSS-FSNS) (p< 0,001). Tuy nhiên, sự khác biệt có ý nghĩa thống kê (p=0,002) ở nhóm cariprazin so với nhóm risperidon được ghi nhận từ tuần 14 trở đi (Bảng 2). Cả hai nhóm bệnh nhân điều trị bằng cariprazin và risperidon đều cho thấy sự cải thiện có ý nghĩa thống kê các thông số về hiệu quả phụ so với ban đầu, tổng điểm PSP (năng lực hành vi cá nhân và xã hội - Personal and Social Performance) (p<0,001). Tuy nhiên, sự khác biệt có ý nghĩa thống kê (p<0,001) ở nhóm dùng cariprazin vượt trội hơn so với nhóm dùng risperidon được ghi nhận từ tuần thứ 10 trở đi (Bảng 2).
Sự khác biệt về mức độ tiến triển trên lâm sàng (CGI-S, p=0,005) và các thang cải thiện (p<0,001), cũng như tỷ lệ đáp ứng điểm số PANSS đối với các triệu chứng âm tính (PANSS FSNS ≥ 30% cải thiện ở tuần 26; p= 0,003) bổ sung thêm cho những kết quả trên các thông số đánh giá hiệu quả chính và phụ.
- xem Bảng 2.
 Quần thể bệnh nhi
Quần thể bệnh nhi
Cục quản lý Dược châu Âu đã hoãn việc bắt buộc phải đệ trình kết quả nghiên cứu của cariprazin trên quần thể bệnh nhi. Xem mục
Liều lượng và cách dùng về thông tin sử dụng thuốc cho bệnh nhi.
Đặc tính dược động học
Cariprazin có 2 chất chuyển hóa có tác dụng dược lý với hoạt tính tương tự cariprazin là desmethyl cariprazin (DCAR) và didesmethyl cariprazin (DDCAR). Tổng phơi nhiễm cariprazin (Tổng của cariprazin + DCAR và DDCAR) trong khoảng 1 tuần với liều dùng hàng ngày đạt khoảng 50% so với mức phơi nhiễm ở trạng thái ổn định, trong khi đó đạt 90% so với mức phơi nhiễm ở trạng thái ổn định trong 3 tuần. Ở trạng thái ổn định, mức phơi nhiễm DDCAR cao gấp khoảng 2 đến 3 lần so với cariprazin, và mức phơi nhiễm DCAR bằng khoảng 30% mức phơi nhiễm cariprazin.
Hấp thu
Sinh khả dụng tuyệt đối của cariprazin chưa được biết. Cariprazin được hấp thu tốt sau khi uống. Sau khi dùng liều lặp lại, nồng độ đỉnh huyết tương của cariprazin và các chất chuyển hóa chính có hoạt tính thường đạt được ở khoảng 3-8 giờ sau khi uống.
Dùng liều đơn 1,5 mg cariprazin với bữa ăn giàu chất béo (900 đến 1.000 calo) không ảnh hưởng có ý nghĩa đến C
max hoặc AUC của cariprazin (AUC
0-ꝏ tăng 12%, C
max giảm < 5% trong điều kiện ăn no so với khi đói). Thức ăn cũng ít ảnh hưởng đến phơi nhiễm các chất chuyển hóa DCAR và DDCAR.Cariprazin có thể được dùng trước, trong hoặc sau bữa ăn.
Phân bố
Dựa trên một phân tích dược động học quần thể, thể tích phân bố biểu kiến (V/F) của cariprazin (CAR) là 916 lít, DCAR là 475 lít và DDCAR là 1.568 lít, cho thấy cariprazin và các chất chuyển hóa chính có hoạt tính có mức độ phân bố rộng. Cariprazin và các chất chuyển hóa chính có hoạt tính gắn kết mạnh với protein huyết tương (96 đến 97% đối với CAR, 94% đến 97% đối với DCAR và 92% đến 97% với DDCAR).
Sinh chuyển hóa
Quá trình chuyển hóa của cariprazin bao gồm sự dimethyl hóa (DCAR và DDCAR), hydroxyl hóa (hydroxy-cariprazin, HCAR) và kết hợp dimethyl hóa và hydroxyl hóa (hydroxy-desmethyl-cariprazin: HDCAR và hydroxy-didesmethyl-cariprazin: HDDCAR). Các chất chuyển hóa của HCAR, HDCAR và HDDCAR sau đó được sinh chuyển hóa dưới dạng liên hợp sulfat và glucuronid tương ứng. Một chất chuyển hóa khác, acid desdichlorophenyl-piperazin-cariprazin (DDCPPCAR) được tạo ra từ quá trình dealkyl hóa và oxy hóa cariprazin.
Cariprazin được chuyển hóa bởi CYP3A4 và, ở mức độ ít hơn, bởi CYP2D6, thành DCAR và HCAR. DCAR được chuyển hóa tiếp bởi CYP3A4 và ở mức độ ít hơn bởi CYP2D6 thành DDCAR và HDCAR. DDCAR được chuyển hóa tiếp thành HDDCAR bởi CYP3A4.
Cariprazin và các chất chuyển hóa chính có hoạt tính không là cơ chất của P-glycoprotein (P-gp), đây là chuỗi polypeptid vận chuyển anion hữu cơ 1B1 và 1B3 (OATP1B1 và OATP1B3), và protein kháng ung thư vú (BCRP). Điều này gợi ý rằng dường như không có tương tác giữa cariprazin với các chất ức chế P-gp, OATP1B1, OATP1B3 và BCRP.
Thải trừ
Cariprazin và các chất chuyển hóa chính có hoạt tính được thải trừ chủ yếu qua chuyển hóa ở gan. Sau khi dùng liều cariprazin 12,5 mg/ngày cho bệnh nhân tâm thần phân liệt, 20,8% liều dùng được thải trừ qua nước tiểu dưới dạng cariprazin và các chất chuyển hóa.
Cariprazin dạng không biến đổi được thải trừ 1,2% liều dùng qua nước tiểu và 3,7% liều dùng qua phân.
Nửa đời pha cuối trung bình (1 đến 3 ngày đối với cariprazin và DCAR, và 13 đến 19 ngày đối với DDCAR) không dự đoán được thời gian đạt được trạng thái ổn định hoặc nồng độ thuốc trong huyết tương giảm sau khi ngừng điều trị. Trong việc điều trị cho bệnh nhân dùng cariprazin, nửa đời hiệu quả có liên quan nhiều hơn đến nửa đời pha cuối. Nửa đời hiệu quả khoảng 2 ngày đối với cariprazin và DCAR, 8 ngày đối với DDCAR và khoảng 1 tuần đối với cariprazin tổng cộng. Nồng độ huyết tương của cariprazin toàn phần giảm dần sau khi ngừng thuốc hoặc dùng thuốc gián đoạn. Nồng độ huyết tương của cariprazin toàn phần giảm 50% trong khoảng 1 tuần và giảm hơn 90% nồng độ cariprazin toàn phần trong khoảng 3 tuần.
Tuyến tính
Sau khi dùng liều lặp lại, phơi nhiễm cariprazin và các chất chuyển hóa chính có hoạt tính, desmethyl cariprazin (DCAR) và didesmethyl cariprazin (DDCAR), tăng tỷ lệ trong khoảng liều điều trị từ 1,5 đến 6 mg.
Các quần thể đặc biệt
Suy thận
Mô hình dược động học quần thể được thực hiện bằng cách sử dụng dữ liệu từ các bệnh nhân tham gia chương trình nghiên cứu lâm sàng cariprazin trong điều trị tâm thần phân liệt với chức năng thận ở các mức độ khác nhau, bao gồm chức năng thận bình thường (thanh thải creatinin (CrCl) ≥ 90 mL/phút), suy thận nhẹ (CrCl 60 đến 89 mL/phút) và trung bình (CrCl 30 đến 59 mL/phút). Không tìm thấy mối liên quan có ý nghĩa giữa độ thanh thải cariprazin huyết tương và thanh thải creatinin. Cariprazin không được đánh giá trên bệnh nhân suy thận nặng (CrCl < 30 mL/phút) (xem mục
Liều lượng và cách dùng).
Suy gan
Một nghiên cứu gồm 2 phần (dùng liều đơn 1 mg cariprazin [Phần A] và liều hàng ngày 0,5 mg cariprazin trong 14 ngày [Phần B] được thực hiện trên bệnh nhân có chức năng gan suy giảm ở các mức độ khác nhau (Phân nhóm Child-Pugh A và B). So với người khỏe mạnh, các bệnh nhân suy gan nhẹ hoặc trung bình phơi nhiễm cariprazin (C
max và AUC) cao hơn khoảng 25% và phơi nhiễm các chất chuyển hóa chính có hoạt tính, desmethyl cariprazin và didesmethyl cariprazin giảm khoảng 45%, sau khi dùng liều đơn 1 mg cariprazin hoặc 0,5 mg cariprazin trong 14 ngày. Tổng phơi nhiễm (AUC và C
max) các thành phần có hoạt tính (CAR+DCAR+DDCAR) giảm tương ứng 21-22% và 13-15% trong các trường hợp suy gan nhẹ hoặc trung bình, so với người khỏe mạnh, nếu tính đến cả nồng độ dạng gắn kết và không gắn kết, trong khi tổng các phần không gắn kết giảm 12-13% và tăng 20-25% đã được tính đến tương ứng trên bệnh nhân suy gan nhẹ và trung bình, sau khi dùng các liều cariprazin lặp lại.Cariprazin chưa được đánh giá trên các bệnh nhân suy gan nặng (Phân nhóm Child-Pugh C) (xem mục
Liều lượng và cách dùng).
Tuổi, giới tính và chủng tộc
Trong phân tích dược động học quần thể, không có sự khác biệt tương quan lâm sàng về các thông số dược động học (AUC và C
max của tổng cariprazin và các chất chuyển hóa có hoạt tính chính) theo tuổi, giới tính và chủng tộc. Phân tích này có 2.844 bệnh nhân thuộc các chủng tộc khác nhau, bao gồm 536 bệnh nhân từ 50 đến 65 tuổi. Trong số 2.844 bệnh nhân có 933 bệnh nhân là nữ (xem mục
Liều lượng và cách dùng). Dữ liệu trên bệnh nhân trên 65 tuổi còn hạn chế.
Tình trạng hút thuốc
Do cariprazin không là cơ chất của CYP1A2, hút thuốc không được xem là có ảnh hưởng đến dược động học của cariprazin.Khả năng cariprazin ảnh hưởng đến các thuốc khác Cariprazin và các chất chuyển hóa chính có hoạt tính không gây cảm ứng enzym CYP1A2, CYP2B6 và CYP3A4 và không phải là các chất ức chế CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP219, CYP2D6, CYP2E1 và CYP3A4
in vitro. Cariprazin và các chất chuyển hóa chính có hoạt tính không phải là chất ức chế các chất vận chuyển OATP1B1, OATP1B3, BCRP, chất vận chuyển cation hữu cơ 2 (OCT2), và chất vận chuyển anion hữu cơ 1 và 3 (OAT1 và OAT3) in vitro. DCAR và DDCAR không phải là các chất ức chế chất vận chuyển P-gp mặc dù cariprazin là chất ức chế P-gp tại ruột (xem mục
Tương tác).
Dữ liệu an toàn tiền lâm sàng
Trên chó cariprazin gây đục thủy tinh thể cả hai bên và làm thay đổi võng mạc thứ cấp (bong võng mạc và thoái hóa thể nang). Mức độ phơi nhiễm (AUC của cariprazin toàn phần) ở mức độ không ghi nhận tác dụng phụ (NOAEL) về độc tính trên mắt cao gấp 4,2 lần AUC lâm sàng ở mức liều tối đa khuyến cáo dùng cho người (MRHD) là 6 mg/ngày. Tăng tỷ lệ mắc thoái hóa/teo võng mạc được ghi nhận trên chuột albino trong thời gian nghiên cứu 2 năm ở các mức phơi nhiễm tương quan lâm sàng.
Rối loạn biến dưỡng phospholipid đã được ghi nhận trong phổi chuột cống, chó và chuột nhắt (kèm hoặc không kèm tình trạng viêm) và trong vỏ thượng thận trên chó ở mức phơi nhiễm tương quan lâm sàng. Tình trạng viêm được ghi nhận trên phổi chó trong 1 năm với mức không ghi nhận tác dụng phụ ở mức phơi nhiễm AUC cao gấp 2,7 lần (trên giống đực) và 1,7 lần (trên giống cái) so với phơi nhiễm lâm sàng tại liều tối đa khuyến cáo dùng cho người. Không ghi nhận tình trạng viêm ở cuối giai đoạn 2 tháng không dùng thuốc sau khi phơi nhiễm ở mức gấp 4,2 lần mức phơi nhiễm lâm sàng ở liều tối đa khuyến cáo dùng cho người; tuy nhiên, tình trạng viêm vẫn xuất hiện ở các liều cao hơn.
Phì đại vỏ thượng thận được ghi nhận ở mức gấp 4,1 lần so với mức phơi nhiễm lâm sàng ở liều tối đa khuyến cáo dùng cho người trên chuột cống (chỉ ở giống cái) và ở nồng độ huyết tương của cariprazin toàn phần tương quan lâm sàng ở chuột nhắt. Trên chó, phì đại/tăng sản và tạo không bào/tạo nang có hồi phục ở vỏ thượng thận đã được ghi nhận với mức độ không ghi nhận tác dụng phụ cao hơn gấp 4,2 lần nồng độ tối đa khuyến cáo dùng cho người trên lâm sàng.
Trên chuột cống cái, khả năng sinh sản và chỉ số thụ thai thấp hơn đã được ghi nhận ở mức phơi nhiễm tương quan lâm sàng tính theo mg/m
2 diện tích da. Không có ảnh hưởng nào trên khả năng sinh sản của chuột cống đực được ghi nhận ở mức phơi nhiễm lên đến 4,8 lần so với mức phơi nhiễm trên lâm sàng ở mức liều tối đa khuyến cáo dùng cho người.
Dùng cariprazin cho chuột cống trong giai đoạn hình thành các cơ quan đã gây dị tật, tỷ lệ chuột con sống sót thấp hơn và làm chậm sự phát triển ở mức phơi nhiễm thuốc thấp hơn mức độ phơi nhiễm trên người ở mức liều tối đa khuyến cáo dùng cho người là 6 mg/ngày. Trên thỏ, cariprazin gây độc tính trên thỏ mẹ nhưng không gây độc tính trên bào thai ở mức phơi nhiễm cao hơn gấp 5,8 lần mức phơi nhiễm trên lâm sàng ở mức liều tối đa khuyến cáo dùng cho người.
Sử dụng cariprazin cho chuột cống mang thai trong giai đoạn hình thành các cơ quan, trong suốt thời kỳ mang thai và cho con bú ở mức độ phơi nhiễm tương quan trên lâm sàng làm giảm tỷ lệ chuột sống sau sinh, trọng lượng chuột mới sinh và trọng lượng sau cai sữa ở chuột con thế hệ đầu. Ngoài ra, cơ thể lạnh, nhợt nhạt và chậm phát triển (nhú thận không phát triển/phát triển kém và giảm đáp ứng thính giác trên con đực) đã được ghi nhận trong trường hợp không thấy có độc tính trên chuột mẹ. Khả năng sinh sản của chuột con thế hệ đầu không bị ảnh hưởng, tuy nhiên, thế hệ con thứ 2 cũng có các dấu hiệu lâm sàng tương tự và trọng lượng cơ thể thấp hơn.
Cariprazin và các chất chuyển hóa của nó được bài tiết vào sữa mẹ ở chuột cống.




 Đăng xuất
Đăng xuất