Cơ chế tác động
Osimertinib là chất ức chế Tyrosine Kinase (TKI). Đây là chất ức chế không thuận nghịch thụ thể yếu tố phát triển biểu bì (Epidermal Growth Factor Receptors - EGFRs) có đột biến nhạy cảm (EGFRm) và đột biến T790M đề kháng với TKI.
Tác động về dược lực
Các nghiên cứu in vitro đã cho thấy osimertinib có tác động ức chế hiệu quả cao thụ thể EGFR bằng các bước điều trị các tế bào ung thư phổi không phải tế bào nhỏ có đột biến T790M và đột biến EGFRm nhạy cảm trên lâm sàng (xét nghiệm phospho-EGFR cho thấy IC50s rõ rệt từ 6 nM đến 54 nM). Điều này dẫn đến ức chế sự phát triển của tế bào trong khi cho thấy ít có tác động đáng kể trên EGFR của các tế bào không có đột biến (wild-type cell lines) (xét nghiệm phospho-EGFR cho thấy IC50s rõ rệt từ 480 nM đến 1,8 μM). Khi dùng osimertinib đường uống in vivo làm cho khối u co lại ở cả mẫu khối u ghép ngoại lai và biến đổi gen trên phổi chuột có tế bào ung thư phổi không tế bào nhỏ có đột biến EGFRm và T790M.
Điện sinh lý học trên tim
Khả năng kéo dài khoảng QTc khi dùng TAGRISSO đã được đánh giá trên 210 bệnh nhân đang dùng osimertinib 80 mg/ngày trong nghiên cứu AURA2. Các giá trị ECG đã được thu thập sau khi dùng 1 liều osimertinib và khi thuốc đã nồng độ hằng định để đánh giá tác động của osimertinib trên khoảng QTc. Phân tích dược động học/dược lực học dự đoán khả năng kéo dài khoảng QTc liên quan đến thuốc ở liều 80 mg là 14 mili giây với trị số giới hạn trên là 16 mili giây (độ tin cậy 90% CI).
Hiệu quả và an toàn trên lâm sàng
Điều trị bổ trợ ung thư phổi không tế bào nhỏ (NSCLC) có đột biến EGFR dương tính, có hoặc không có điều trị bằng hóa trị bổ trợ trước đó - ADAURA
An toàn và hiệu quả của TAGRISSO trong điều trị bổ trợ trên bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) có đột biến EGFR dương tính (Ex19del hoặc L858R), sau khi phẫu thuật cắt bỏ khối u hoàn toàn có hoặc không có điều trị bằng hóa trị bổ trợ trước đó, đã được chứng minh trong một nghiên cứu ngẫu nhiên, mù đôi, đối chứng với giả dược (ADAURA).
Những bệnh nhân đủ điều kiện có khối u có thể phẫu thuật ở giai đoạn IB-IIIA (phân loại theo Ủy ban Liên hiệp Hoa Kỳ về phân giai đoạn ung thư [AJCC] ấn bản lần thứ 7) phải có đột biến EGFR (Ex19del hoặc L858R), được xác định qua xét nghiệm đột biến EGFR cobas thực hiện tiến cứu bằng cách sử dụng mẫu sinh thiết hoặc mẫu phẫu thuật tại phòng thí nghiệm trung tâm.
Bệnh nhân được phân nhóm ngẫu nhiên theo tỷ lệ 1:1 dùng thuốc TAGRISSO (n=339, dùng liều 80 mg uống một lần/ngày) hay giả dược (n=343) sau khi hồi phục sau phẫu thuật và được điều trị bằng hóa trị bổ trợ chuẩn. Sau phẫu thuật, bệnh nhân không được hóa trị bổ trợ được phân ngẫu nhiên trong vòng 10 tuần và bệnh nhân được nhận hóa trị bổ trợ được phân ngẫu nhiên trong vòng 26 tuần. Việc phân ngẫu nhiên được phân tầng theo kiểu đột biến EGFR (Ex19del hoặc L858R), chủng tộc (châu Á hoặc không phải châu Á) và giai đoạn (IB hoặc II hoặc IIIA) dựa trên kỹ thuật sinh thiết xuyên thành ngực bằng kim [percutaneous transthoracic needle biopsy (pTNM)] theo AJCC ấn bản lần thứ 7. Tiếp tục điều trị cho đến khi bệnh tái phát, hoặc độc tính không thể chấp nhận hoặc cho đến 3 năm.
Các tiêu chí hiệu quả chính là thời gian sống không bệnh (disease-free survival DFS) được xác định bằng đánh giá của nghiên cứu viên trên dân số ở giai đoạn II-IIIA. DFS theo đánh giá của nghiên cứu viên trên dân số ở giai đoạn IB-IIIA (dân số tổng thể) là tiêu chí hiệu quả bổ sung. Các tiêu chí hiệu quả bổ sung khác bao gồm tỷ lệ DFS, thời gian sống còn toàn bộ (OS), tỷ lệ OS và thời gian cho đến khi giảm sút chất lượng cuộc sống liên quan đến sức khỏe (health-related quality of life - HRQoL) bằng cách sử dụng bảng câu hỏi SF-36.
Các đặc tính cơ bản về nhân trắc học và bệnh lý của dân số tổng thể là: tuổi trung vị 63 tuổi (khoảng 30-86 tuổi), bệnh nhân ≥ 75 tuổi (11%), phụ nữ (70%), chủng tộc châu Á (64%), chưa bao giờ hút thuốc (72%), bệnh nhân có điểm thể trạng theo WHO là 0 (64%) hoặc 1 (36%), giai đoạn IB (31%), giai đoạn II (34%) và IIIA (35%). Về tình trạng đột biến EGFR, có 55% là đột biến dạng mất đoạn exon 19 và 45% là đột biến điểm exon 21 L858R; 9 bệnh nhân (1%) có đột biến T790M de novo đồng thời. Phần lớn (60%) bệnh nhân được điều trị hóa trị bổ trợ trước khi phân nhóm ngẫu nhiên (26% IB; 71% IIA; 73% IIB; 80% IIIA). Tại thời điểm cắt dữ liệu, 205 (61%) bệnh nhân vẫn đang điều trị tích cực; trong số đó 73 (11%) bệnh nhân có cơ hội hoàn tất thời gian điều trị 3 năm, 40 (12%) ở nhánh osimertinib và 33 (10%) ở nhánh giả dược.
Có 37 bệnh nhân tái phát bệnh ở nhánh TAGRISSO. Các vị trí tái phát được báo cáo thường gặp nhất là: phổi (19 bệnh nhân), hạch bạch huyết (10 bệnh nhân) và hệ thần kinh trung ương (5 bệnh nhân). 157 bệnh nhân có tái phát bệnh ở nhánh giả dược. Các vị trí tái phát được báo cáo thường gặp nhất là: phổi (61 bệnh nhân); hạch bạch huyết (48 bệnh nhân) và hệ thần kinh trung ương (34 bệnh nhân).
ADAURA đã chứng minh làm giảm nguy cơ tái phát bệnh hoặc tử vong có ý nghĩa thống kê trên những bệnh nhân được điều trị bằng TAGRISSO so với những bệnh nhân được điều trị bằng giả dược trong nhóm dân số giai đoạn II-IIIA. Quan sát thấy kết quả tương tự ở nhóm dân số giai đoạn IB-IIIA. Dữ liệu thời gian sống còn toàn bộ (OS) chưa hoàn thiện tại thời điểm phân tích DFS. Kết quả về hiệu quả trong nghiên cứu ADAURA theo đánh giá của nghiên cứu viên được tóm tắt trong Bảng 1.
- xem Bảng 1, Hình 1 & 2.

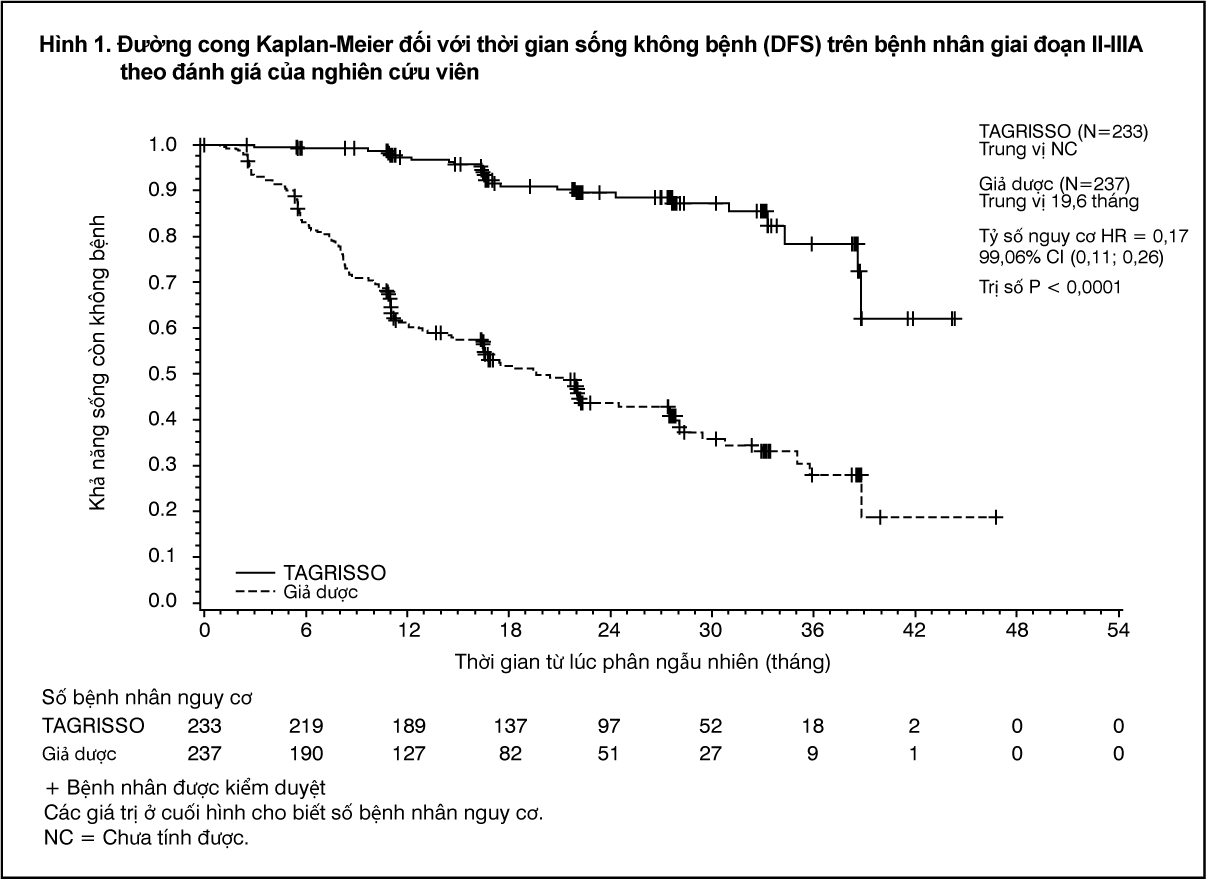
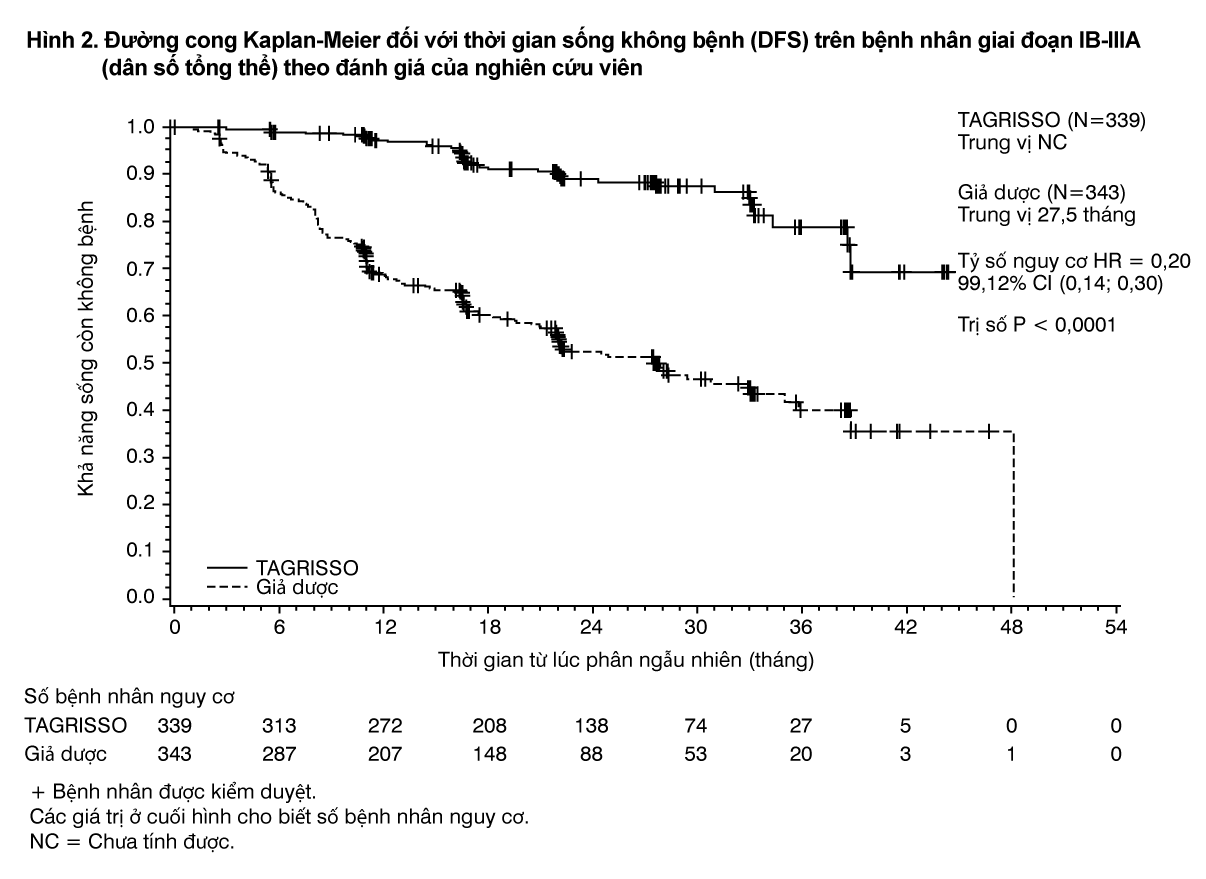
Lợi ích về DFS của TAGRISSO so với giả dược là nhất quán ở tất cả các phân nhóm định trước được phân tích, bao gồm chủng tộc, tuổi, giới tính và loại đột biến EGFR (Ex19del hoặc L858R).
Một phân tích thăm dò về DFS trên hệ thần kinh trung ương (thời gian cho đến khi bệnh tái phát trên hệ thần kinh trung ương hoặc tử vong) trên bệnh nhân ở nhóm TAGRISSO so với bệnh nhân ở nhóm giả dược cho thấy tỷ số nguy cơ HR = 0,18 (95% CI: 0,10; 0,33; p < 0,0001) trong nhóm dân số tổng thể (giai đoạn IB-IIIA).
Kết quả do bệnh nhân ghi nhận (PRO)
Chất lượng cuộc sống liên quan đến sức khỏe (health-related quality of life - HRQL) trong nghiên cứu ADAURA được đánh giá bằng cách sử dụng bảng câu hỏi khảo sát về sức khỏe phiên bản 2 gồm 36 mục [Short Form (36) Health Survey version 2 (SF-36v2)]. Phân nhóm bệnh nhân ngẫu nhiên sử dụng bảng câu hỏi SF-36v2 được tại thời điểm 12 tuần, 24 tuần và sau đó mỗi 24 tuần cho đến khi hoàn tất điều trị hoặc ngừng điều trị. Nhìn chung, HRQL được duy trì đến 30 tháng ở cả 2 nhánh, với ít nhất 70% bệnh nhân ở nhóm dân số giai đoạn II-IIIA không bị suy giảm có ý nghĩa lâm sàng về sức khỏe thể chất đo bằng thang điểm SF-36 hoặc tử vong (70% đối với TAGRISSO so với 76% đối với giả dược), hay về sức khỏe tinh thần đo bằng thang điểm SF-36 hoặc tử vong (70% đối với TAGRISSO so với 71% đối với giả dược).
Bệnh nhân ung thư phổi loại không tế bào nhỏ (NSCLC) giai đoạn tiến triển tại chỗ hay di căn, có đột biến EGFR dương tính chưa được điều trị trước đây - nghiên cứu FLAURA
Hiệu quả và an toàn của TAGRISSO trong việc điều trị bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) có đột biến EGFR dương tính giai đoạn tiến triển tại chỗ không phù hợp với phẫu thuật hoặc xạ trị triệt căn, hoặc bệnh nhân di căn, mà trước đây chưa nhận được điều trị toàn thân khi bệnh tiến xa, đã được chứng minh trong một nghiên cứu ngẫu nhiên, mù đôi, có nhóm chứng theo điều trị chuẩn (FLAURA). Mẫu mô khối u của bệnh nhân được yêu cầu phải có một trong hai đột biến EGFR phổ biến được biết là có liên quan đến nhạy thuốc EGFR TKI (Ex19del hoặc L858R), được xác định bằng xét nghiệm tại chỗ hoặc trung tâm.
Bệnh nhân được phân ngẫu nhiên theo tỷ lệ 1:1 để dùng TAGRISSO (n=279, 80 mg uống mỗi ngày một lần) hoặc dùng thuốc so sánh EGFR TKI (n=277; gefitinib 250 mg uống mỗi ngày một lần hoặc erlotinib 150 mg uống mỗi ngày một lần). Việc phân ngẫu nhiên được phân tầng theo kiểu đột biến EGFR (Ex19del hoặc L858R) và chủng tộc (châu Á hoặc không phải người châu Á). Bệnh nhân được dùng thuốc nghiên cứu cho đến khi không dung nạp với điều trị, hoặc nghiên cứu viên xác định rằng bệnh nhân không còn nhận được lợi ích lâm sàng nữa. Đối với bệnh nhân dùng thuốc so sánh EGFR TKI, được cho phép dùng TAGRISSO nhãn mở sau khi tiến triển bệnh miễn là các mẫu khối u được xét nghiệm dương tính với đột biến T790M. Tiêu chí hiệu quả chính là thời gian sống không bệnh tiến triển (PFS) được đánh giá bởi nghiên cứu viên.
Các đặc tính cơ bản về nhân trắc học và bệnh lý của tổng dân số nghiên cứu là: tuổi trung vị 64 tuổi (trong khoảng từ 26-93 tuổi), ≥ 75 tuổi (14%), nữ (63%), người da trắng (36%), chủng tộc châu Á (62%), không hút thuốc (64%), điểm tổng trạng theo WHO là 0 hoặc 1 (100%), bệnh lý di căn xương (36%), di căn tạng ngoài lồng ngực (35%), di căn hệ thần kinh trung ương (21%, được xác định qua tổn thương thần kinh trung ương lúc ban đầu, tiền sử bệnh, và/hoặc phẫu thuật trước đó, và/hoặc xạ trị trước đó cho tình trạng di căn hệ thần kinh trung ương).
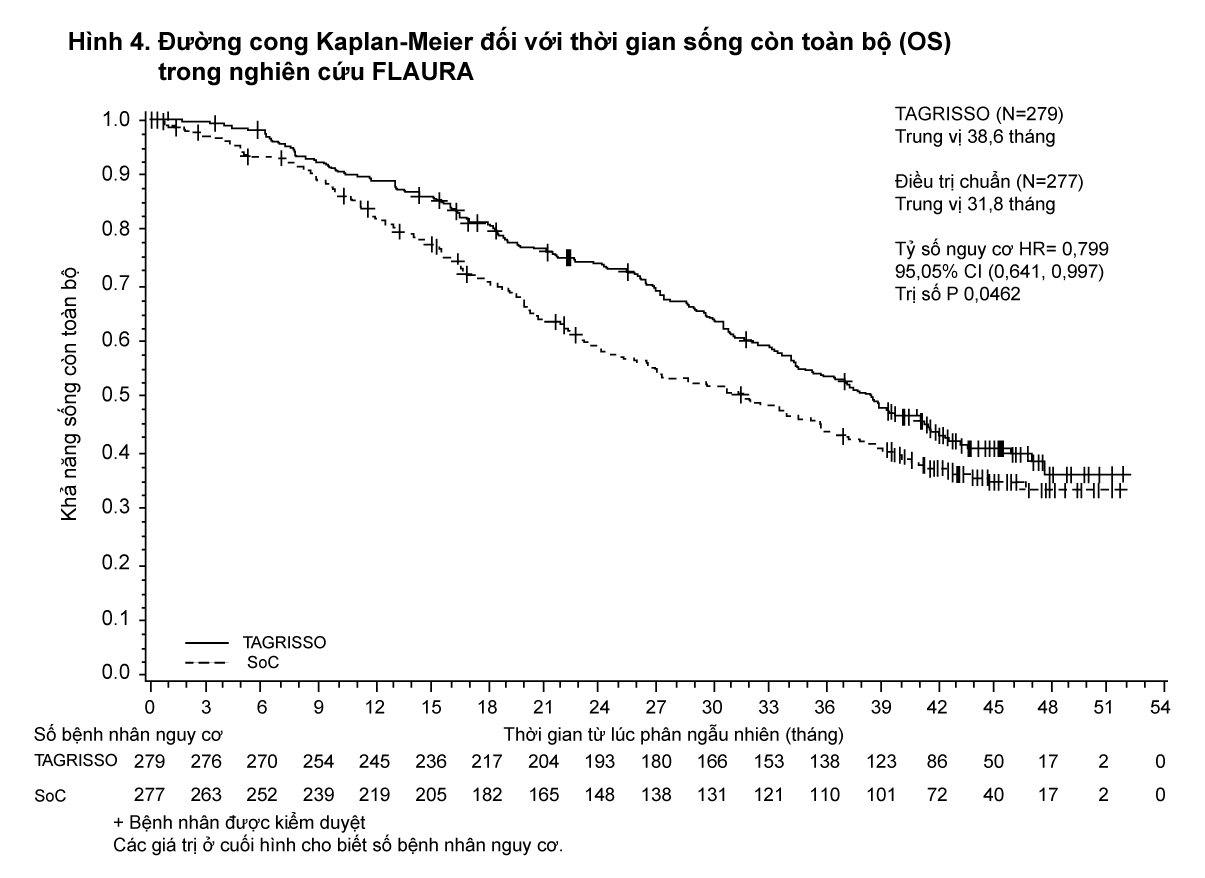
TAGRISSO đã chứng minh cải thiện có ý nghĩa về mặt lâm sàng và có ý nghĩa thống kê đáng kể về PFS so với thuốc so sánh EGFR TKI (PFS trung vị tương ứng là 18,9 tháng và 10,2 tháng, HR = 0,46, 95% CI: 0,37; 0,57, P < 0,0001). Kết quả hiệu quả từ nghiên cứu FLAURA theo đánh giá của nghiên cứu viên được tóm tắt trong Bảng 2, và đồ thị đường cong Kaplan-Meier đối với tiêu chí chính PFS được trình bày trong Hình 3. Phân tích cuối cùng về thời gian sống còn toàn bộ (OS, 58% bệnh nhân đã xảy ra biến cố), cho thấy sự cải thiện đáng kể có ý nghĩa thống kê với HR 0,799 (95,05% CI: 0,641, 0,997) và thời gian sống trung vị dài hơn có ý nghĩa lâm sàng đối với các bệnh nhân được chọn ngẫu nhiên điều trị bằng TAGRISSO so với bệnh nhân dùng thuốc EGFR TKI đối chứng (Bảng 2 và Hình 4). Tỷ lệ bệnh nhân còn sống khi điều trị bằng TAGRISSO tại thời điểm 12, 18, 24 và 36 tháng (tương ứng là 89%, 81%, 74% và 54%) cao hơn so với bệnh nhân dùng thuốc EGFR TKI đối chứng (tương ứng là 83%, 71%, 59% và 41%). Phân tích các tiêu chí sau khi bệnh tiến triển (post-progression end-points) đã cho thấy lợi ích của PFS được duy trì qua các bước điều trị tiếp theo.
- xem Bảng 2, Hình 3 & 4.
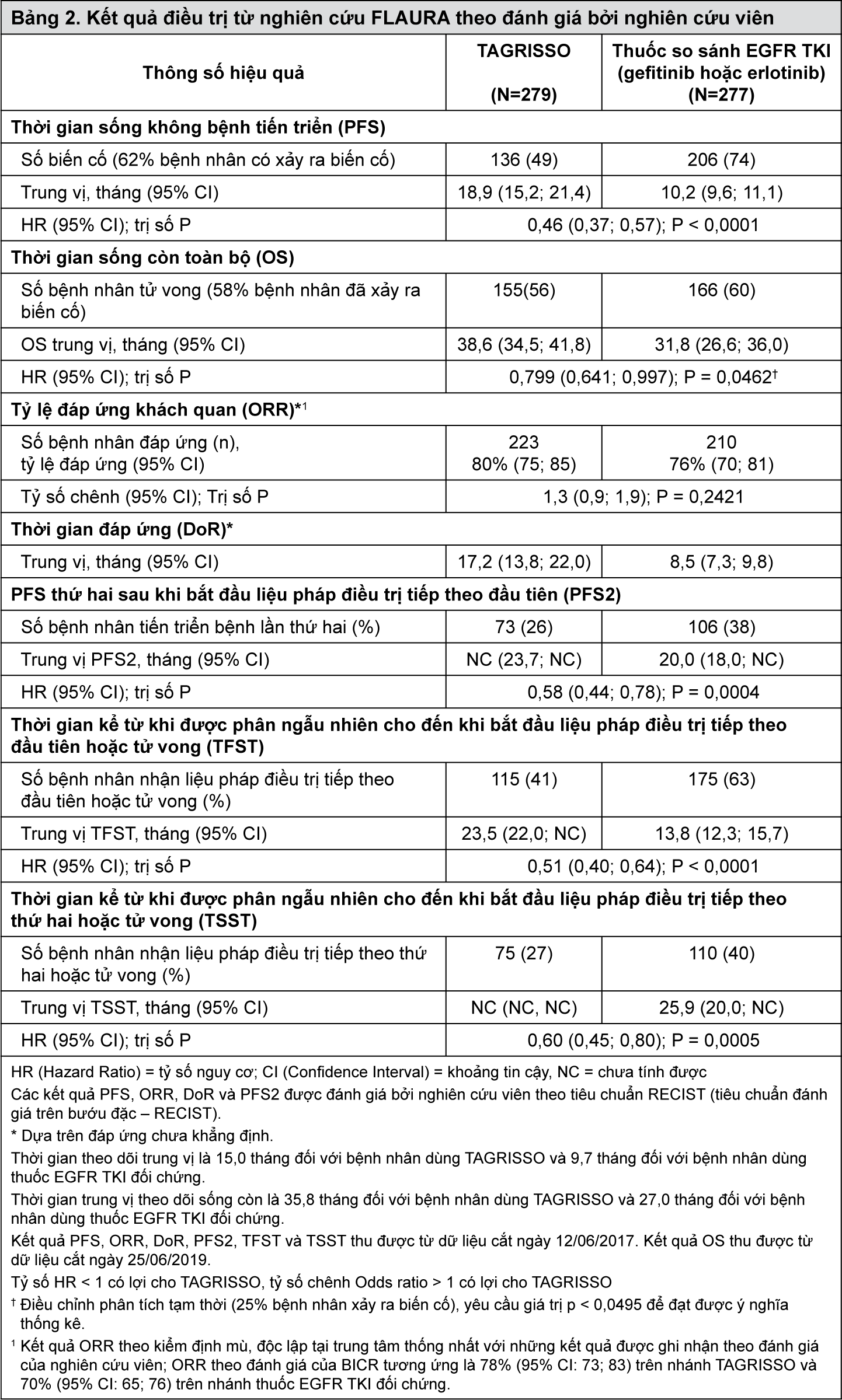
Lợi ích về PFS của TAGRISSO so với thuốc so sánh EGFR TKI là nhất quán ở tất cả các phân nhóm được xác định trước, bao gồm chủng tộc, tuổi, giới tính, tiền sử hút thuốc, tình trạng di căn hệ thần kinh trung ương tại thời điểm tham gia nghiên cứu và loại đột biến EGFR (mất đoạn trên Exon 19 hoặc L858R).
Dữ liệu về hiệu quả trên bệnh nhân di căn hệ thần kinh trung ương trong nghiên cứu FLAURA
Bệnh nhân có di căn hệ thần kinh trung ương không dùng steroid và có thần kinh ổn định trong ít nhất hai tuần sau khi hoàn thành điều trị tình trạng cơ bản và steroid thì có đủ điều kiện để được phân ngẫu nhiên trong nghiên cứu FLAURA. Trong số 556 bệnh nhân, 200 bệnh nhân đã có sẵn các hình ảnh chụp não lúc ban đầu. BICR đánh giá trên các hình ảnh chụp não đã cho thấy một phân nhóm gồm 128/556 (23%) bệnh nhân có di căn hệ thần kinh trung ương. Dữ liệu này được tóm tắt trong Bảng 3. Hiệu quả trên thần kinh trung ương đánh giá theo tiêu chuẩn RECIST v1.1 trong nghiên cứu FLAURA đã chứng minh sự cải thiện có ý nghĩa thống kê về PFS trên hệ thần kinh trung ương (HR = 0,48, 95%CI: 0,26; 0,86, P = 0,014).
- xem Bảng 3.

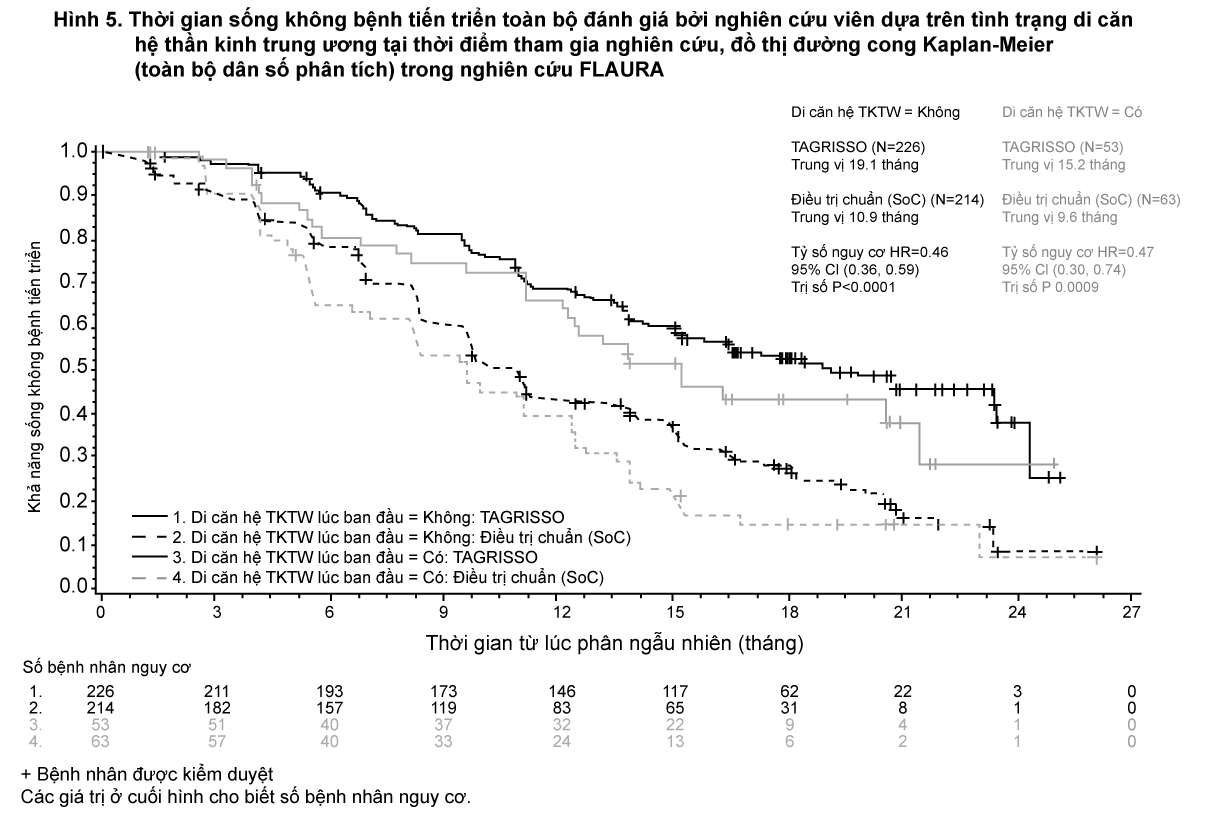
Một phân nhóm PFS được xác định trước dựa trên tình trạng di căn hệ thần kinh trung ương (được xác định bởi tổn thương tại hệ thần kinh trung ương lúc ban đầu, tiền sử bệnh và/hoặc phẫu thuật trước đó, và/hoặc xạ trị trước đó cho di căn hệ thần kinh trung ương) tại thời điểm tham gia nghiên cứu đã được thực hiện trong nghiên cứu FLAURA và được trình bày trong Hình 5. Bất kể tình trạng tổn thương hệ thần kinh trung ương tại thời điểm tham gia nghiên cứu, bệnh nhân trong nhóm TAGRISSO đã chứng minh được có hiệu quả hơn so với nhóm dùng EGFR TKI và có ít bệnh nhân có tổn thương mới trên hệ thần kinh trung ương ở nhóm TAGRISSO so với nhóm so sánh EGFR TKI (TAGRISSO, 11/279 [3,9%] so với nhóm so sánh EGFR TKI, 34/277 [12,3%]). Trên phân nhóm bệnh nhân không có tổn thương thần kinh trung ương lúc ban đầu, có ít tổn thương mới trên hệ thần kinh trung ương ở nhóm TAGRISSO so với nhóm chứng EGFR TKI (tương ứng là 7/226 [3,1%] so với 15/214 [7,0%]).
- xem Hình 5.
Kết quả do bệnh nhân ghi nhận (PRO)
Các triệu chứng do bệnh nhân báo cáo (patient-reported symptoms) và chất lượng cuộc sống liên quan đến sức khỏe (health-related quality of life - HRQL) đã được thu thập qua thiết bị điện tử bằng cách sử dụng bảng câu hỏi EORTC QLQ-C30 và bảng câu hỏi chuyên biệt về ung thư phổi (EORTC QLQ-LC13). Bảng câu hỏi LC13 ban đầu được dùng một lần mỗi tuần trong 6 tuần đầu tiên, sau đó cứ 3 tuần một lần trước và sau khi bệnh tiến triển. Bảng câu hỏi C30 được đánh giá 6 tuần một lần trước và sau khi bệnh tiến triển. Tại thời điểm ban đầu, không có sự khác biệt về triệu chứng do bệnh nhân báo cáo, chức năng hoặc HRQL đã được ghi nhận giữa nhánh TAGRISSO và nhánh dùng thuốc so sánh EGFR TKI (gefitinib hoặc erlotinib). Sự tuân thủ trong 9 tháng đầu cao (≥ 70%) và tương tự ở cả hai nhánh.
* Phân tích các triệu chứng ung thư phổi chính
Dữ liệu thu thập từ thời điểm ban đầu đến tháng 9 cho thấy sự cải thiện tương tự trên nhóm TAGRISSO và nhóm EGFR TKI đối với năm triệu chứng PRO chính được xác định trước (ho, khó thở, đau ngực, mệt mỏi và chán ăn) với sự cải thiện cắt cơn ho trên lâm sàng. Cho đến tháng 9 không có sự khác biệt có ý nghĩa lâm sàng về triệu chứng do bệnh nhân báo cáo giữa các nhóm TAGRISSO và EGFR TKI (được đánh giá bằng mức chênh lệch ≥ 10 điểm).
* HRQL và phân tích cải thiện chức năng thể chất (physical functioning improvement analysis)
Cả hai nhóm đều báo cáo những cải thiện tương tự ở hầu hết các chức năng chính và tình trạng sức khỏe toàn cầu/ HRQL, cho thấy tình trạng sức khỏe tổng thể của bệnh nhân được cải thiện. Tính đến tháng 9, không có sự khác biệt có ý nghĩa lâm sàng giữa nhóm TAGRISSO và nhóm so sánh EGFR TKI về chức năng hoạt động hoặc HRQL.
Bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) có đột biến T790M đã được điều trị trước đó - nghiên cứu AURA3
Hiệu quả và tính an toàn của TAGRISSO trong việc điều trị bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) giai đoạn tiến triển tại chỗ hay di căn, có đột biến T790M khi bệnh tiến triển hoặc sau khi điều trị bằng EGFR TKI đã được chứng minh trong nghiên cứu pha 3 ngẫu nhiên, nhãn mở, có đối chứng (AURA3). Tất cả bệnh nhân phải có đột biến EGFR T790M dương tính được xác định qua xét nghiệm đột biến EGFR cobas thực hiện tại phòng thí nghiệm chính trước khi đưa vào điều trị. Tình trạng đột biến T790M cũng được đánh giá qua việc tháo xoắn các DNA khối u trong tuần hoàn (ctDNA) lấy từ mẫu huyết tương trong khi sàng lọc. Mục tiêu chính đánh giá hiệu quả là thời gian sống không bệnh tiến triển (PFS) theo đánh giá của nghiên cứu viên. Các mục tiêu đo lường hiệu quả bổ sung bao gồm tỷ lệ đáp ứng khách quan (objective response rate - ORR), thời gian đáp ứng (DoR) và thời gian sống còn toàn bộ (OS) theo đánh giá của nghiên cứu viên.
Bệnh nhân được phân nhóm ngẫu nhiên dùng thuốc theo tỷ lệ 2:1, tương ứng là dùng TAGRISSO (n=279) hoặc hóa trị bộ đôi có platinum (n=140). Việc dùng thuốc được phân ngẫu nhiên theo chủng tộc (châu Á và không phải châu Á). Bệnh nhân ở nhánh TAGRISSO dùng liều 80 mg uống một lần/ngày cho đến khi không dung nạp với điều trị, hoặc nghiên cứu viên xác định rằng các bệnh nhân không còn lợi ích lâm sàng. Hóa trị gồm pemetrexed 500 mg/m2 với carboplatin AUC5 hoặc pemetrexed 500 mg/m2 với cisplatin 75 mg/m2) vào ngày 1 của mỗi chu kỳ 21 ngày cho đến 6 chu kỳ. Bệnh nhân không tiến triển bệnh sau bốn chu kỳ hóa trị liệu có platinum như trên có thể được điều trị duy trì bằng pemetrexed (pemetrexed 500 mg/m2 vào ngày 1 của mỗi chu kỳ 21 ngày). Những bệnh nhân trong nhánh hóa trị có bệnh tiến triển trên chẩn đoán hình ảnh (theo nghiên cứu viên và được xác định qua chẩn đoán hình ảnh độc lập) sẽ có cơ hội được bắt đầu điều trị bằng TAGRISSO.
Các đặc tính cơ bản về nhân trắc học và bệnh lý của dân số nghiên cứu là tuổi trung vị 62 tuổi, bệnh nhân ≥ 75 tuổi (15%), phụ nữ (64%), người da trắng (32%), chủng tộc châu Á (65%), không hút thuốc (68%), 100% bệnh nhân có trị số thể trạng theo WHO là 0 hoặc 1. Có 54% bệnh nhân đã bị di căn tạng ngoài lồng ngực (extra-thoracic visceral metastases), trong đó có 34% bị di căn hệ thần kinh trung ương (được xác định qua sang thương thần kinh trung ương ở mức cơ bản, tiền sử y khoa, và/hoặc phẫu thuật trước đó, và/hoặc xạ trị trước khi di căn hệ thần kinh trung ương) và 23% di căn gan. Có 41% bệnh nhân bị di căn xương.
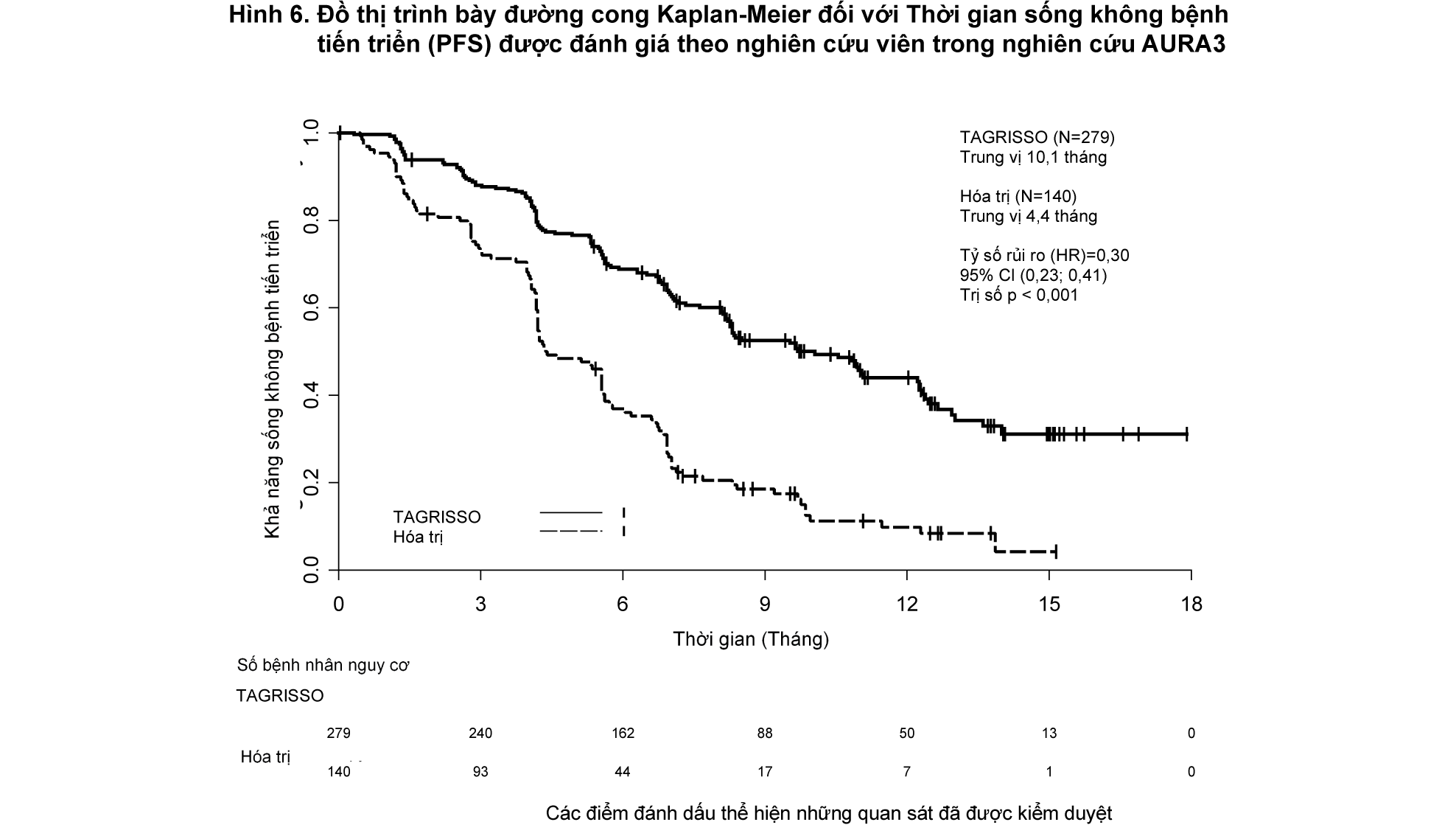
Nghiên cứu AURA3 cho thấy sự cải thiện có ý nghĩa thống kê về PFS trên nhánh bệnh nhân điều trị bằng TAGRISSO so với nhánh dùng hóa trị. Bảng 4 tóm tắt kết quả về hiệu quả của nghiên cứu AURA3 theo đánh giá từ nghiên cứu viên và Hình 6 trình bày đồ thị đường cong Kaplan-Meier đối với PFS. Phân tích cuối cùng về thời gian sống còn toàn bộ (OS) cho thấy không có sự khác biệt đáng kể có ý nghĩa thống kê giữa các nhánh điều trị.
- xem Bảng 4 & Hình 6.

Phân tích độ nhạy đối với PFS được Hội đồng độc lập thẩm định mù (BICR) thực hiện đã cho thấy PFS đạt được trung vị là 11,0 tháng ở nhánh TAGRISSO so với 4,2 tháng ở nhánh hóa trị. Phân tích này cho thấy hiệu quả điều trị phù hợp với đánh giá của nghiên cứu viên (HR 0,28; 95% CI: 0,20; 0,38).
Cải thiện có ý nghĩa về mặt lâm sàng đối với PFS với tỷ số rủi ro HRs < 0,50 có lợi cho nhánh bệnh nhân dùng TAGRISSO so với nhánh hóa trị, ghi nhận này là nhất quán trong tất cả các phân nhóm xác định trước đã phân tích, bao gồm cả chủng tộc, tuổi tác, giới tính, tiền sử hút thuốc và đột biến EGFR (đột biến mất đoạn ở Exon 19 và đột biến điểm L858R).
Dữ liệu về hiệu quả trên di căn hệ thần kinh trung ương trong nghiên cứu AURA3
Bệnh nhân đủ điều kiện để được chọn ngẫu nhiên vào nghiên cứu là bệnh nhân có di căn não ổn định, không triệu chứng, không được chỉ định dùng corticosteroids trong tối thiểu là 4 tuần trước khi bắt đầu điều trị. Bảng 5 tóm tắt đánh giá của BICR về hiệu quả trên hệ thần kinh trung ương căn cứ theo tiêu chuẩn RECIST v1.1 trên 116 trong tổng số 419 bệnh nhân (chiếm tỷ lệ 28%) đã xác định là di căn hệ thần kinh trung ương bằng phương tiện chẩn đoán hình ảnh não tại thời điểm tham gia nghiên cứu.
- xem Bảng 5.

AURA3 có định trước việc đánh giá PFS cho phân nhóm có di căn trên hệ thần kinh trung ương được xác định tại đầu vào của nghiên cứu, thể hiện ở Hình 7.
- xem Hình 7.
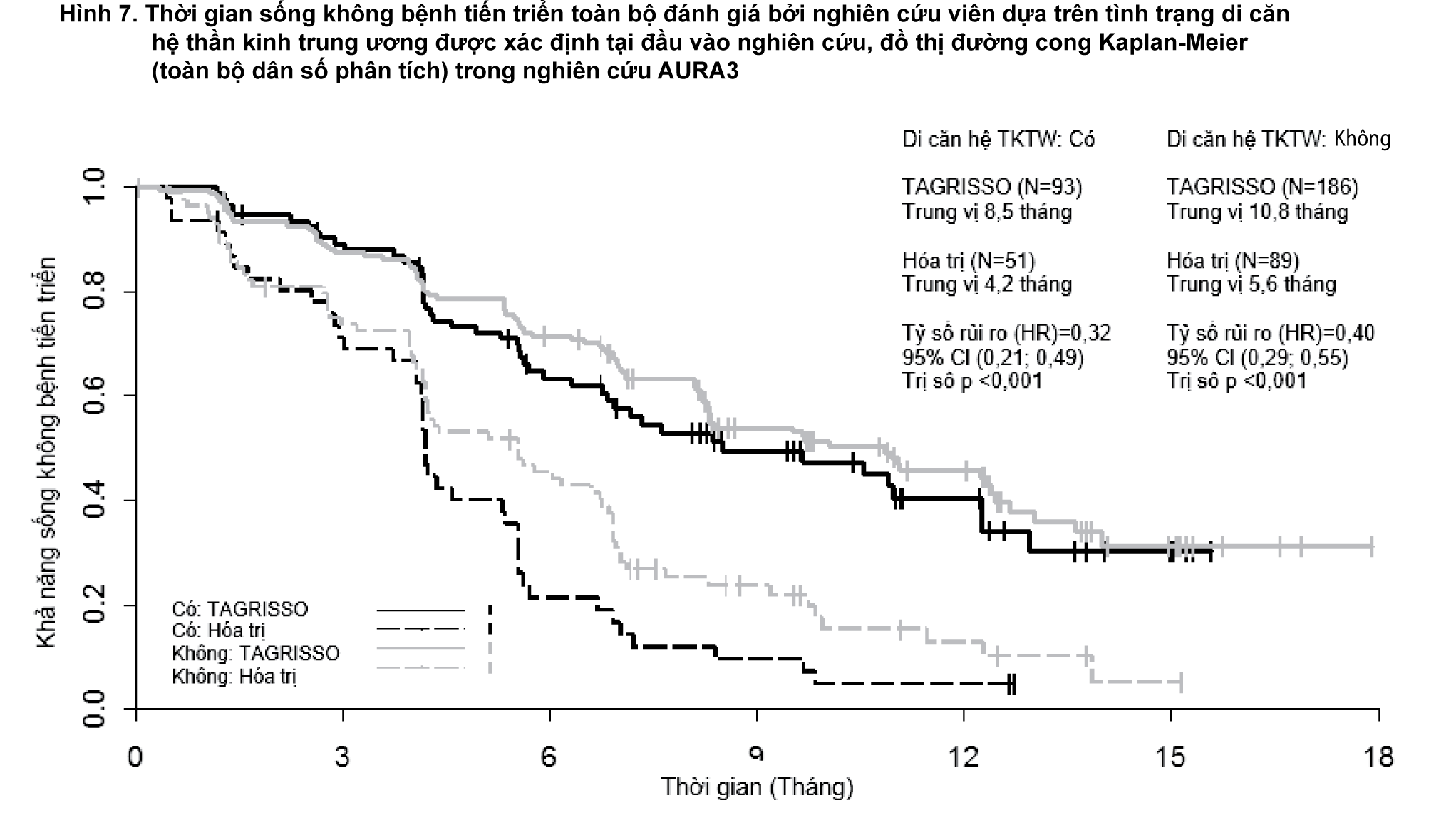
AURA3 cho thấy sự cải thiện đáng kể có ý nghĩa thống kê về PFS trên bệnh nhân dùng TAGRISSO so với bệnh nhân dùng hóa trị bất kể tình trạng di căn hệ thần kinh trung ương tại thời điểm tham gia nghiên cứu.
Kết quả do bệnh nhân ghi nhận
Các triệu chứng do bệnh nhân báo cáo (patient-reported symptoms) và chất lượng cuộc sống liên quan đến sức khỏe (health-related quality of life - HRQL) đã được thu thập qua thiết bị điện tử bằng cách sử dụng bảng câu hỏi EORTC QLQ-C30 và bảng câu hỏi chuyên biệt về ung thư phổi (EORTC QLQ-LC13). Bảng câu hỏi LC13 ban đầu được dùng một lần một tuần trong 6 tuần đầu tiên, sau đó mỗi 3 tuần trước và sau khi bệnh tiến triển. Bảng câu hỏi C30 được đánh giá mỗi 6 tuần trước và sau khi bệnh tiến triển.
* Phân tích các triệu chứng ung thư phổi chính
TAGRISSO làm cải thiện các triệu chứng ung thư phổi do bệnh nhân báo cáo so với hóa trị qua sự khác biệt có ý nghĩa thống kê về sự thay đổi đáng kể so với ban đầu trên toàn bộ thời gian từ khi phân nhóm ngẫu nhiên cho đến 6 tháng đối với 5 triệu chứng chính được xác định trước (chán ăn, ho, đau ngực, khó thở và mệt mỏi) được thể hiện trong Bảng 6.
- xem Bảng 6.

* Chất lượng cuộc sống liên quan đến sức khỏe (HRQL) và phân tích cải thiện chức năng thể chất (physical functioning improvement analysis)
Bệnh nhân dùng TAGRISSO có cơ hội lớn hơn đáng kể đạt được sự cải thiện có ý nghĩa lâm sàng lớn hơn hoặc bằng 10 điểm về tình trạng sức khỏe toàn cầu và chức năng thể chất theo Bảng câu hỏi EORTC C30 so với hóa trị liệu trong thời gian nghiên cứu. Tỷ suất chênh (OR) của tình trạng sức khỏe toàn cầu là: 2,11 (95% CI 1,24; 3,67; p=0,007); Tỷ suất chênh (OR) của chức năng thể chất là: 2,79 (95% CI 1,50; 5,46; p=0,002).
Bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) có đột biến T790M trước khi điều trị - trong nghiên cứu AURAex và AURA2
Các nghiên cứu lâm sàng 2 nhánh riêng lẻ, nhãn mở gồm nghiên cứu đoàn hệ mở rộng pha 2 [AURAex (n=201)) và nghiên cứu pha 2 (AURA2 (n=210)] đã được thực hiện trên bệnh nhân ung thư phổi có đột biến EGFR T790M và bệnh tiến triển sau một hoặc nhiều liệu pháp điều trị toàn thân trước đây, kể cả liệu pháp EGFR TKI. Toàn bộ bệnh nhân được yêu cầu phải có đột biến EGFR T790M dương tính được xác định qua xét nghiệm đột biến EGFR đo bằng hệ thống cobas trong phòng xét nghiệm trung tâm trước khi đưa vào điều trị. Tình trạng đột biến T790M cũng được đánh giá bằng cách đánh giá hồi cứu ctDNA trích xuất từ mẫu huyết tương thu thập trong khi sàng lọc. Toàn bộ bệnh nhân được cho dùng TAGRISSO với liều 80 mg, 1 lần/ngày. Mục tiêu chính đánh giá hiệu quả của hai nghiên cứu này là tỷ lệ đáp ứng khách quan (Objective response rate - ORR) theo tiêu chuẩn RECIST v1.1 bởi BICR. Mục tiêu phụ đo lường hiệu quả bao gồm thời gian đáp ứng (Duration of Response - DoR) và thời gian sống không bệnh tiến triển (Progression-Free Survival - PFS).
Đặc điểm cơ bản của dân số nghiên cứu tổng thể (AURAex và AURA2) như sau: độ tuổi trung vị 63 năm, bệnh nhân ≥ 75 tuổi (13%), phụ nữ (68%), người da trắng (36%), châu Á (60%). Toàn bộ bệnh nhân đều được nhận ít nhất là điều trị bước 1 trước khi đưa vào nghiên cứu. Ba mươi mốt phần trăm (31%) (N=129) đã nhận điều trị bước 1 trước khi điều trị (bằng EGFR-TKI), 69% (N=282) đã nhận được điều trị bước 2 hoặc nhiều hơn. Bảy mươi hai phần trăm (72%) bệnh nhân là người không hút thuốc, 100% bệnh nhân có chỉ số thể trạng theo Tổ chức Y tế Thế giới (WHO) là 0 hoặc 1. Năm mươi chín phần trăm (59%) bệnh nhân đã có di căn tạng ngoài lồng ngực, trong đó có 39% bệnh nhân bị di căn trên hệ thần kinh trung ương (CNS) (được xác định bởi sang thương trên thần kinh trung ương so với trị số cơ bản, tiền sử y khoa, và/hoặc phẫu thuật trước đó và/hoặc xạ trị trước khi di căn CNS) và 29% có di căn gan. Bốn mươi bảy phần trăm (47%) bệnh nhân có bệnh di căn xương. Thời gian theo dõi trung vị đối với PFS là 12,6 tháng.
Trong 411 bệnh nhân có đột biến EGFR T790M dương tính trước khi điều trị, trị số ORR tổng quát theo đánh giá của BICR là 66% (95% CI: 61; 71). Ở bệnh nhân có đáp ứng đã được xác nhận bởi BICR, DOR trung vị là 12,5 tháng (95% CI: 11,1; NE). ORR theo BICR trong AURAex và AURA2 tương ứng là 62% (95% CI: 55; 68) và 70% (95% CI: 63; 77). PFS trung vị là 11,0 tháng; 95% CI (9,6; 12,4).
Tỷ lệ đáp ứng khách quan theo BICR đã được ghi nhận là trên 50% ở tất cả các phân nhóm phân tích được xác định trước, bao gồm các liệu pháp điều trị, chủng tộc, tuổi tác và khu vực.
Khi đánh giá đáp ứng trên toàn bộ dân số, 85% (223/262) được ghi nhận là có đáp ứng tại thời điểm rà soát đầu tiên (6 tuần); 94% (247/262) ghi nhận dữ liệu đáp ứng tại thời điểm rà soát thứ hai (12 tuần).
Dữ liệu hiệu quả trên bệnh nhân di căn CNS trong các nghiên cứu pha 2 (AURAex và AURA2)
Đánh giá của BICR về hiệu quả CNS theo tiêu chuẩn RECIST v 1.1 đã được thực hiện trong một phân nhóm gồm 50 bệnh nhân (trong tổng số 411 bệnh nhân) được xác định có di căn CNS đo được trên hình ảnh scan não. Tỷ lệ đáp ứng khách quan (ORR) trên CNS là 54% (27/50 bệnh nhân; 95% CI: 39,3; 68,2) được quan sát, trong đó có 12% đáp ứng hoàn toàn.
Các nghiên cứu lâm sàng đã không được tiến hành đối với bệnh nhân NSCLC có đột biến EGFR T790M ngay từ đầu (de novo EGFR T790M).
Trẻ em
Tính an toàn và hiệu quả của TAGRISSO ở trẻ em và trẻ vị thành niên < 18 tuổi chưa được thiết lập. Hiện chưa có dữ liệu.




 Đăng xuất
Đăng xuất

