Các nghiên cứu trên bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) có đột biến EGFR dương tính
Dữ liệu đề cập dưới đây phản ánh việc tiếp xúc với thuốc TAGRISSO trên 1.479 bệnh nhân ung thư phổi loại không tế bào nhỏ (NSCLC) có đột biến EGFR dương tính. Các bệnh nhân này đã được điều trị với TAGRISSO liều 80 mg mỗi ngày trong ba nghiên cứu ngẫu nhiên pha 3 (ADAURA, bổ trợ; FLAURA, bước 1 và AURA 3, bước 2), hai nghiên cứu đơn nhánh (AURAex và AURA2, bước 2 hoặc trễ hơn) và một nghiên cứu pha 1 (AURA1, bước 1 hoặc trễ hơn) (xem phần Dược lực học). Đa số các phản ứng ngoại ý ở cấp độ 1 hoặc 2. Các phản ứng ngoại ý thường gặp nhất được ghi nhận là tiêu chảy (47%), nổi mẩn (45%), viêm quanh móng (33%), khô da (32%) và viêm miệng (24%). Các phản ứng ngoại ý cấp độ 3 và 4 trong các nghiên cứu này chiếm tỷ lệ tương ứng là 10% và 0,1%. Việc giảm liều do ADR xảy ra chiếm tỷ lệ 3,4% trên tổng số bệnh nhân đang dùng TAGRISSO 80 mg, 1 lần/ngày. Ngưng thuốc do gặp phản ứng ngoại ý chiếm tỷ lệ 4,8%.
Bệnh nhân có tiền sử bệnh phổi mô kẽ (ILD), đã dùng thuốc gây ILD, viêm phổi do xạ trị phải dùng steroid, hoặc có bất kỳ bằng chứng ILD tiến triển trên lâm sàng đã được loại trừ khỏi các nghiên cứu lâm sàng này. Bệnh nhân có bất thường về nhịp và dẫn truyền quan trọng trên lâm sàng được xác định bằng ECG lúc nghỉ (ví dụ khoảng QTc lớn hơn 470 mili giây) đã được loại trừ. Bệnh nhân được đánh giá LVEF khi tầm soát và mỗi 12 tuần theo dõi sau đó.
Bảng phân loại phản ứng ngoại ý
Các phản ứng ngoại ý được ấn định theo nhóm tần suất xảy ra tại Bảng 7 dựa trên tỷ lệ báo cáo phản ứng ngoại ý trong dữ liệu gộp từ 1479 bệnh nhân ung thư phổi loại không tế bào nhỏ có đột biến EGFR dương tính được điều trị với TAGRISSO liều 80 mg mỗi ngày trong các nghiên cứu ADAURA, FLAURA, AURA3, AURAex, AURA 2 và AURA1.
Các phản ứng ngoại ý do thuốc được liệt kê theo nhóm hệ cơ quan (SOC) trong MedDRA. Trên mỗi nhóm hệ cơ quan, các phản ứng ngoại ý được xếp hạng dựa theo tần suất xảy ra với các phản ứng xảy ra thường xuyên nhất được liệt kê đầu tiên. Trong mỗi nhóm tần suất, phản ứng ngoại ý được liệt kê theo mức nghiêm trọng giảm dần. Ngoài ra, phân loại tần suất tương ứng cho mỗi ADR được dựa trên quy ước CIOMS III và định nghĩa như sau: rất thường gặp (≥1/10); thường gặp (≥1/100 - <1/10); không thường gặp (≥1/1.000 - <1/100); hiếm gặp (≥1/10.000 - <1/1.000); rất hiếm (<1/10.000); chưa rõ (không thể dự đoán từ dữ liệu sẵn có).
- xem Bảng 8.
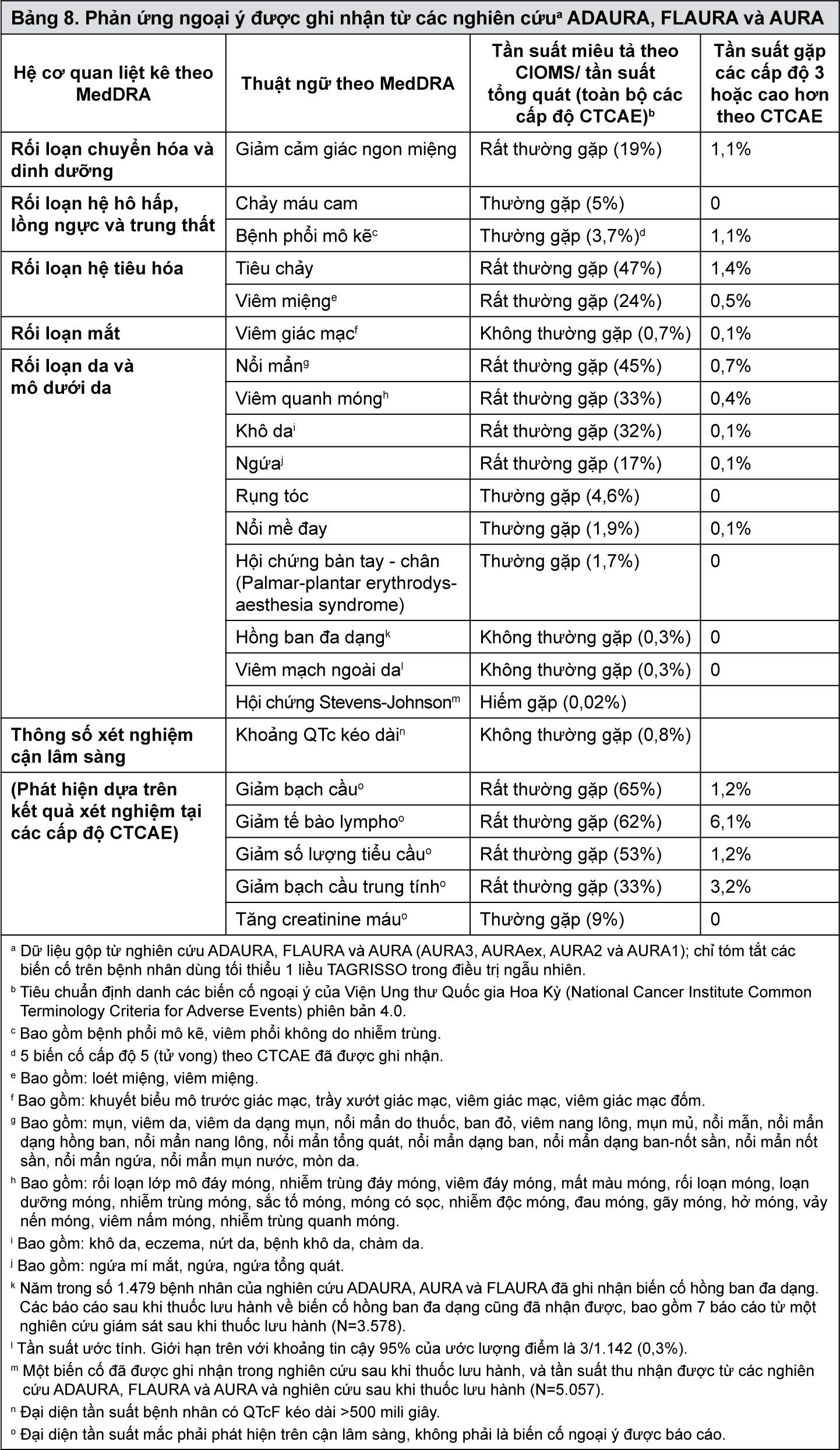
Mô tả một số phản ứng ngoại ý chọn lọc
Bệnh phổi mô kẽ (ILD)
Trong các nghiên cứu ADAURA, FLAURA và AURA, tần suất xảy ra ILD là 11% ở bệnh nhân Nhật Bản, 1,6% ở bệnh nhân châu Á không phải người Nhật Bản và 2,5% ở nhóm không phải bệnh nhân châu Á. Thời gian trung vị khởi phát ILD hoặc phản ứng ngoại ý giống ILD là 84 ngày (xem phần Cảnh báo và thận trọng và Dược lực học).
Khoảng QTc kéo dài
Trên 1.479 bệnh nhân trong các nghiên cứu ADAURA, FLAURA và AURA điều trị bằng TAGRISSO 80 mg, có 0,8% số bệnh nhân (n=12) được phát hiện có khoảng QTc > 500 mili giây, và 3,1% số bệnh nhân (n=46) có khoảng QTc tăng > 60 mili giây so với trị số ban đầu. Một phân tích dược động học/dược lực học với TAGRISSO đã dự báo nguy cơ gia tăng khoảng QTc kéo dài phụ thuộc vào liều. Không ghi nhận biến cố loạn nhịp liên quan đến QTc trong các nghiên cứu ADAURA, FLAURA hoặc AURA (xem phần Cảnh báo và thận trọng và Dược lực học).
Ảnh hưởng trên dạ dày-ruột
Trong nghiên cứu ADAURA, FLAURA và AURA, tiêu chảy được báo cáo ở 47% bệnh nhân trong đó 38% ở cấp độ 1, 7,9% cấp độ 2 và 1,4% ở cấp độ 3; không có báo cáo ở cấp độ 4 hoặc 5. Có 0,3% bệnh nhân được yêu cầu giảm liều và 2% bệnh nhân được yêu cầu ngưng thuốc tạm thời. Bốn biến cố (0,3%) dẫn đến ngưng điều trị. Trong nghiên cứu ADAURA, FLAURA và AURA3, thời gian trung vị khởi phát tương ứng là 22 ngày, 19 ngày và 22 ngày và thời gian trung vị của biến cố cấp độ 2 tương ứng là 11 ngày, 19 ngày và 6 ngày.
Biến cố huyết học
Việc giảm sớm số lượng trung vị bạch cầu, bạch cầu lympho, bạch cầu trung tính và tiểu cầu trên xét nghiệm đã được quan sát thấy ở những bệnh nhân điều trị bằng TAGRISSO, số lượng này ổn định theo thời gian và sau đó vẫn duy trì trên giới hạn dưới của mức bình thường. Các biến cố ngoại ý liên quan đến giảm bạch cầu, giảm bạch cầu lympho, giảm bạch cầu trung tính và giảm tiểu cầu đã được báo cáo, hầu hết trong số đó là ở mức độ nhẹ hoặc trung bình và không dẫn đến ngưng thuốc.
Người cao tuổi
Trong nghiên cứu ADAURA, FLAURA và AURA3 (n=1.479), có 43% số bệnh nhân ở độ tuổi ≥ 65 tuổi, và 12% bệnh nhân ≥ 75 tuổi. Tỷ lệ phản ứng ngoại ý dẫn đến chỉnh liều thuốc nghiên cứu (ngưng thuốc hoặc giảm liều) được ghi nhận nhiều hơn ở bệnh nhân ≥ 65 tuổi so với nhóm bệnh nhân trẻ hơn (< 65) (16% so với 9%). Loại phản ứng ngoại ý là tương tự nhau bất kể tuổi tác. Bệnh nhân cao tuổi gặp nhiều phản ứng ngoại ý cấp độ 3 hoặc cao hơn so với nhóm bệnh nhân trẻ tuổi hơn (13% so với 8%). Không ghi nhận có sự khác biệt về hiệu quả của thuốc giữa nhóm bệnh nhân cao tuổi này và nhóm trẻ tuổi hơn. Một kết quả tương tự về tính an toàn và hiệu quả cũng được quan sát thấy khi phân tích các nghiên cứu AURA pha 2.
Bệnh nhân có thể trọng thấp
Bệnh nhân điều trị với TAGRISSO 80 mg có thể trọng thấp (< 50 kg) ghi nhận xảy ra với tần suất cao hơn về các biến cố ngoại ý cấp độ ≥ 3 (46% so với 31%) và khoảng QTc kéo dài (12% so với 5%) so với bệnh nhân có thể trọng cao (≥ 50 kg).
Báo cáo phản ứng ngoại ý nghi ngờ do thuốc
Báo cáo các phản ứng ngoại ý nghi ngờ do thuốc sau khi thuốc được cấp phép lưu hành là quan trọng. Điều này cho phép tiếp tục theo dõi sự cân bằng giữa nguy cơ/lợi ích của thuốc. Cán bộ y tế được yêu cầu báo cáo bất kỳ tác dụng không mong muốn nào qua hệ thống báo cáo quốc gia.
View ADR Monitoring Form




 Đăng xuất
Đăng xuất

