Cơ chế tác động và đặc tính dược lực học
Olaparib là một chất ức chế mạnh đối với những enzyme poly (ADP ribose) polymerase trên người (PARP-1, PARP-2 và PARP-3), và đã được chứng minh về khả năng ức chế tăng trưởng các dòng tế bào khối u có chọn lọc trong in vitro và sự phát triển khối u trong in vivo khi điều trị đơn hoặc kết hợp với các thuốc hóa trị liệu.
Enzyme poly (ADP ribose) polymerase (PARP) cần thiết trong quá trình sửa chữa một cách hiệu quả các đứt gãy sợi đơn DNA. Một khía cạnh quan trọng của việc sửa chữa do PARP (PARP induced repair) là sau khi sửa đổi nhiễm sắc thể, PARP tự động điều chỉnh và tách khỏi DNA để tạo điều kiện cho sự tiếp cận của các enzyme sửa chữa cắt bỏ bazơ (base excision repair - BER). Khi olaparib gắn kết với vị trí hoạt động của PARP đang gắn với DNA, sẽ ngăn chặn sự phân ly của PARP và giữ nó lại trên DNA, vì vậy ức chế quá trình sửa chữa. Trong quá trình sao chép tế bào, điều này cũng dẫn đến sự hình thành các đứt gãy sợi kép DNA (DNA double strand breaks - DSB) khi các nhánh sao chép tháo xoắn gặp phối hợp PARP-DNA. Trên tế bào bình thường, quá trình sửa chữa tái tổ hợp tương đồng (homologous recombination repair-HRR pathway) có hiệu quả trong việc sửa chữa các đứt gãy sợi kép DNA này. Trên tế bào ung thư thiếu các thành phần chức năng quan trọng như BRCA1 hoặc 2 cho quá trình sửa chữa tái tổ hợp tương đồng hiệu quả, các đứt gãy sợi kép DNA không thể được sửa chữa chính xác hoặc hiệu quả, dẫn đến suy giảm chức năng chức năng tái tổ hợp tương đồng (HRD) đáng kể. Thay vào đó, các quá trình thay thế và dễ bị lỗi được kích hoạt, chẳng hạn như quá trình kinh điển bổ sung những đoạn không tương đồng (non homologous end joining - NHEJ), dẫn đến sự mất ổn định bộ gen (genomic instability) ở mức độ cao. Sau một số vòng sao chép, sự mất ổn định bộ gen (genomic instability) có thể đạt đến mức không thể hỗ trợ và dẫn đến kết quả gây chết tế bào ung thư, vì các tế bào ung thư vốn đã có mức độ tổn thương DNA tương đối cao hơn so với các tế bào bình thường. Quá trình sửa chữa tái tổ hợp tương đồng có thể bị tổn hại bởi các cơ chế khác, mặc dù sự bất thường nhân quả và độ thâm nhập chưa được làm rõ hoàn toàn. Sự vắng mặt của quá trình sửa chữa tái tổ hợp tương đồng đầy đủ chức năng là một trong những yếu tố chính quyết định độ nhạy đối với hóa trị chứa platinum trong ung thư buồng trứng và các bệnh lý ung thư có thể khác.
Trong các mô hình thiếu hụt BRCA1/2 in vivo, olaparib được dùng sau khi hóa trị với platinum dẫn đến sự chậm tiến triển khối u và tăng thời gian sống còn so với chỉ dùng hóa trị với platinum, điều này tương quan với thời gian điều trị duy trì với olaparib.
Phát hiện đột biến gen BRCA1/2
Xét nghiệm di truyền nên được thực hiện tại phòng xét nghiệm có kinh nghiệm, với phương pháp thực hiện đã được công nhận. Xét nghiệm về đột biến gen BRCA1/2 dạng di truyền và/hoặc dạng mắc phải trên mẫu máu và/ hoặc mẫu khối u đã được sử dụng trong các nghiên cứu khác nhau tại phòng xét nghiệm trung tâm hay tại địa phương hoặc trung tâm. Phần lớn các nghiên cứu đều xét nghiệm DNA thu được từ mẫu máu hoặc mẫu mô, trong đó xét nghiệm với ctDNA (circulating tumor DNA - DNA của khối u trong hệ tuần hoàn) được sử dụng chủ yếu cho mục đích thăm dò. Tùy thuộc vào xét nghiệm sử dụng và đồng thuận phân loại quốc tế, các đột biến gen BRCA1/2 được phân loại là nguy hiểm (deleterious)/ nghi ngờ nguy hiểm (suspected deleterious) hoặc gây bệnh (pathogenic)/ có khả năng gây bệnh (likely pathogenic). Suy giảm chức năng tái tổ hợp tương đồng (HRD) có thể coi là dương tính nếu đột biến gen BRCA1/2 được phân loại ở mức nguy hiểm (deleterious)/nghi ngờ nguy hiểm (suspected deleterious) hoặc gây bệnh (pathogenic)/ có khả năng gây bệnh (likely pathogenic). Ngoài ra, suy giảm chức năng tái tổ hợp tương đồng (HRD) có thể coi là dương tính khi đánh giá kết hợp cả xét nghiệm đột biến gen và thang điểm HRD (được mô tả bên dưới).
Phát hiện sự bất ổn định bộ gen (genomic instability)
Các biến thể trên bộ gen liên quan đến suy giảm chức năng tái tổ hợp tương đồng (HRD) được đánh giá trong nghiên cứu PAOLA-1 thông qua việc mất tính dị hợp tử (LOH - loss of heterozygosity), mất cân bằng alen (TAI - telomeric allelic imbalance) và đứt gãy nhiễm sắc thể kích thước lớn (LST - Large-scale State Transition) tính trên cả bộ gen; các đặc điểm này được đo lường với các tiêu chí và thang điểm được xác định trước với phép đo liên tục. Bộ thang điểm bất ổn định gen (GIS - Genomic instability score, còn được gọi là thang điểm HRD) được xác định khi kết hợp cả ba điểm số nói trên; và mỗi điểm số tương ứng được sử dụng để đánh giá mức độ của một loại sai lệch cụ thể tích lũy trong bộ gen của tế bào khối u. Tính tại thời điểm lấy mẫu có liên quan đến các tác nhân gây tổn thương DNA, điểm số càng nhỏ thì khả năng suy giảm chức năng tái tổ hợp tương đồng (HRD) của tế bào khối u càng thấp, và điểm số càng lớn thì khả năng HRD của tế bào khối u càng cao. Trong việc xác định tình trạng GIS dương tính, nên chọn điểm giới hạn (cut-off) được công nhận.
Tình trạng HRD dương tính có thể được xác định bằng bộ thang điểm bất ổn định gen (GIS) cho trường hợp biến thể liên quan đến HRD và nên được thực hiện tại phòng xét nghiệm có kinh nghiệm, với phương pháp thực hiện đã được công nhận.
Hiệu quả và an toàn trên lâm sàng
Điều trị duy trì bước 1 trên ung thư buồng trứng giai đoạn tiến xa có đột biến gen BRCA
Nghiên cứu SOLO1
Tính an toàn và hiệu quả của olaparib khi điều trị duy trì trên bệnh nhân ung thư buồng trứng thể thanh dịch hoặc dạng nội mạc tử cung độ mô học cao có đột biến gen BRCA1/2 (BRCA1/2m) giai đoạn tiến xa mới được chẩn đoán (FIGO giai đoạn III-IV) sau khi hoàn tất hóa trị bước 1 có platinum đã được nghiên cứu trong một thử nghiệm pha III đa trung tâm đối chứng với giả dược, mù đôi, ngẫu nhiên. Trong thử nghiệm này, 391 bệnh nhân được phân ngẫu nhiên theo tỷ lệ 2:1 để nhận Lynparza (300 mg [2 x viên nén 150 mg] hai lần mỗi ngày) hoặc giả dược. Bệnh nhân được phân tầng dựa trên đáp ứng với hóa trị liệu bước 1 chứa platinum; có đáp ứng hoàn toàn (CR) hoặc đáp ứng một phần (PR). Tiếp tục điều trị cho đến khi tiến triển bệnh trên hình ảnh học, độc tính không được chấp nhận hoặc cho đến 2 năm. Đối với những bệnh nhân vẫn đáp ứng lâm sàng hoàn toàn (nghĩa là không có bằng chứng bệnh trên hình ảnh học), thời gian điều trị tối đa là 2 năm; tuy nhiên, những bệnh nhân có bằng chứng bệnh vẫn ổn định (nghĩa là không có bằng chứng tiến triển bệnh) có thể tiếp tục nhận Lynparza lâu hơn 2 năm.
Bệnh nhân có đột biến gen BRCA1/2 dạng di truyền (germline) hoặc dạng mắc phải (somatic) được xác định tiến cứu từ xét nghiệm đột biến di truyền trong máu qua một xét nghiệm tại địa phương (n=208) hoặc xét nghiệm trung tâm (n=181) hoặc từ xét nghiệm mẫu khối u bằng xét nghiệm tại địa phương (n=2). Qua xét nghiệm đột biến dạng germline bởi xét nghiệm trung tâm, tỷ lệ các đột biến nguy hiểm (deleterious) hoặc nghi ngờ nguy hiểm (suspected deleterious) đã được xác định trên bệnh nhân tương ứng là 95,3% (365/383) và 4,7% (18/383). Việc tái sắp xếp trên diện rộng các gen BRCA1/2 đã được phát hiện ở 5,5% (21/383) trong số bệnh nhân phân ngẫu nhiên. Tình trạng đột biến gen BRCA dạng di truyền (germline) của bệnh nhân qua xét nghiệm tại địa phương đã được xác nhận hồi cứu bằng xét nghiệm trung tâm. Xét nghiệm hồi cứu trên bệnh nhân với các mẫu khối u có sẵn đã được thực hiện bằng xét nghiệm trung tâm và cho thấy kết quả thành công ở 341 bệnh nhân, trong đó 95% có đột biến đủ điều kiện (được biết là gây bệnh [n = 47] hoặc có khả năng gây bệnh (likely pathogenic) [n = 277]) và 2 bệnh nhân mang gen BRCA dạng di truyền (germline) thể hoang dại (wild-type) đã xác nhận chỉ có đột biến gen BRCA dạng mắc phải (somatic). Trong nghiên cứu SOLO1, có 389 bệnh nhân có đột biến gen BRCA1/2 dạng di truyền (germline) và 2 bệnh nhân có đột biến gen BRCA1/2 dạng mắc phải (somatic).
Các đặc điểm nhân trắc học và trước khi điều trị nhìn chung cân bằng tốt giữa các nhánh điều trị bằng olaparib và giả dược. Tuổi trung vị là 53 tuổi ở cả hai nhánh. Ung thư buồng trứng là khối u nguyên phát ở 85% bệnh nhân. Loại mô học phổ biến nhất là thể thanh dịch (96%), mô học nội mạc tử cung được báo cáo ở 2% bệnh nhân. Hầu hết bệnh nhân có chỉ số tổng trạng theo ECOG bằng 0 (78%), không có dữ liệu ở bệnh nhân có chỉ số tổng trạng từ 2 đến 4. Sáu mươi ba phần trăm (63%) bệnh nhân đã phẫu thuật giảm tổng khối bướu trước hóa trị (upfront debulking surgery) và trong đó phần lớn (75%) không có bệnh tồn dư đại thể (macroscopic residual disease). Phẫu thuật giảm tổng khối bướu giữa kỳ điều trị (Interval debulking surgery) được thực hiện ở 35% bệnh nhân và trong đó có 82% không ghi nhận có bệnh tồn dư đại thể. Bảy bệnh nhân, tất cả đều ở giai đoạn IV, không có phẫu thuật giảm khối bướu. Tất cả bệnh nhân đã được điều trị bước 1 với hóa trị chứa platinum. Không có bằng chứng bệnh lý trước khi vào nghiên cứu (nghĩa là đáp ứng hoàn toàn - CR), được xác định bởi nghiên cứu viên khi không có bằng chứng về bệnh trên hình ảnh học và kháng nguyên ung thư 125 (CA-125) trong phạm vi bình thường ở 73% và 77% bệnh nhân tương ứng ở nhóm olaparib và giả dược. Đáp ứng một phần (PR) được định nghĩa khi có hiện diện của bất kỳ sang thương có thể đo lường hoặc không thể đo lường lúc ban đầu hoặc khi CA-125 tăng, đã được báo cáo ở lần lượt là 27% và 23% bệnh nhân trong nhóm olaparib và giả dược. Chín mươi ba phần trăm (93%) bệnh nhân được phân ngẫu nhiên trong vòng 8 tuần kể từ khi dùng hóa trị có platinum liều cuối. Bệnh nhân đã được điều trị bằng bevacizumab đã bị loại khỏi nghiên cứu, do đó không có dữ liệu về tính an toàn và hiệu quả trên bệnh nhân olaparib mà trước đây đã dùng bevacizumab. Dữ liệu hạn chế trên bệnh nhân bị đột biến BRCA thể mắc phải (somatic).
Tiêu chí nghiên cứu chính là thời gian sống bệnh không tiến triển (PFS) được xác định là thời gian từ khi phân ngẫu nhiên vào nghiên cứu cho đến khi bệnh tiến triển được xác định bằng đánh giá bởi nghiên cứu viên sử dụng tiêu chí cải tiến đánh giá đáp ứng trên bướu đặc RECIST 1.1 hoặc tử vong. Tiêu chí hiệu quả phụ bao gồm thời gian từ khi phân ngẫu nhiên đến khi bệnh tiến triển lần thứ hai hoặc tử vong (PFS2), thời gian sống còn toàn bộ (OS), thời gian từ khi phân ngẫu nhiên vào nghiên cứu cho đến khi ngừng điều trị hoặc tử vong (TDT), thời gian từ khi phân ngẫu nhiên vào nghiên cứu cho đến khi bắt đầu điều trị phác đồ kháng ung thư tiếp theo hoặc tử vong (TFST) và chất lượng cuộc sống liên quan đến sức khỏe (HRQoL). Bệnh nhân được đánh giá khối u trước khi tham gia nghiên cứu và sau mỗi 12 tuần trong 3 năm, và sau đó là mỗi 24 tuần tùy theo ngày ngẫu nhiên được phân vào nghiên cứu, cho đến khi có tiến triển bệnh khách quan trên hình ảnh học.
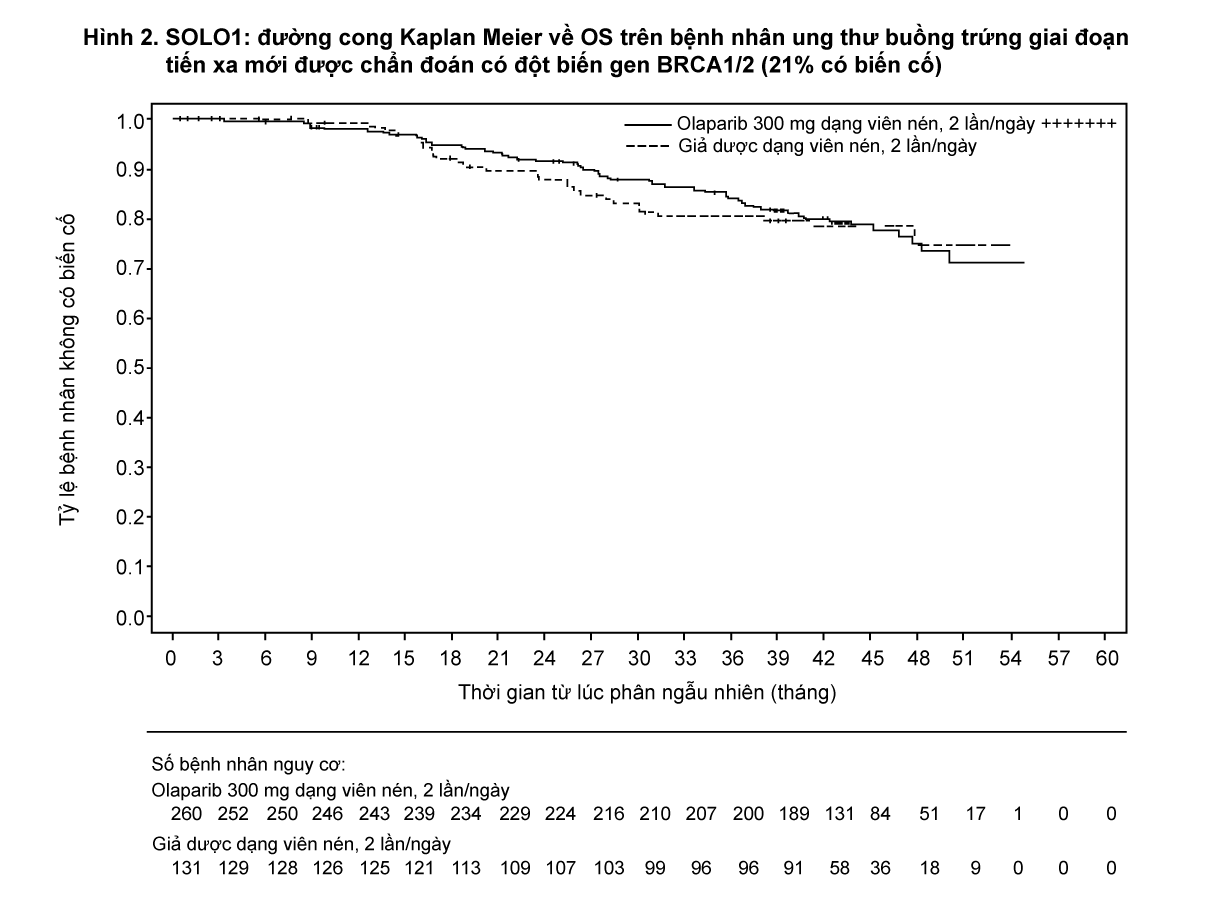
Nghiên cứu cho thấy cải thiện đáng kể về mặt lâm sàng và có ý nghĩa thống kê về PFS theo đánh giá của nghiên cứu viên ở nhánh olaparib so với giả dược. Đánh giá của nghiên cứu viên về PFS đã được hỗ trợ qua đánh giá của Hội đồng độc lập thẩm định mù trên hình ảnh học (blinded independent central radiological BICR review) về PFS. Tại thời điểm phân tích PFS, dữ liệu OS tạm thời chưa hoàn thiện (21%), với HR 0,95 (95% CI 0,60, 1,53; trị số p = 0,9). Kết quả về hiệu quả được trình bày trong Bảng 1, Hình 1 và 2.
- xem Bảng 1, Hình 1 và 2.

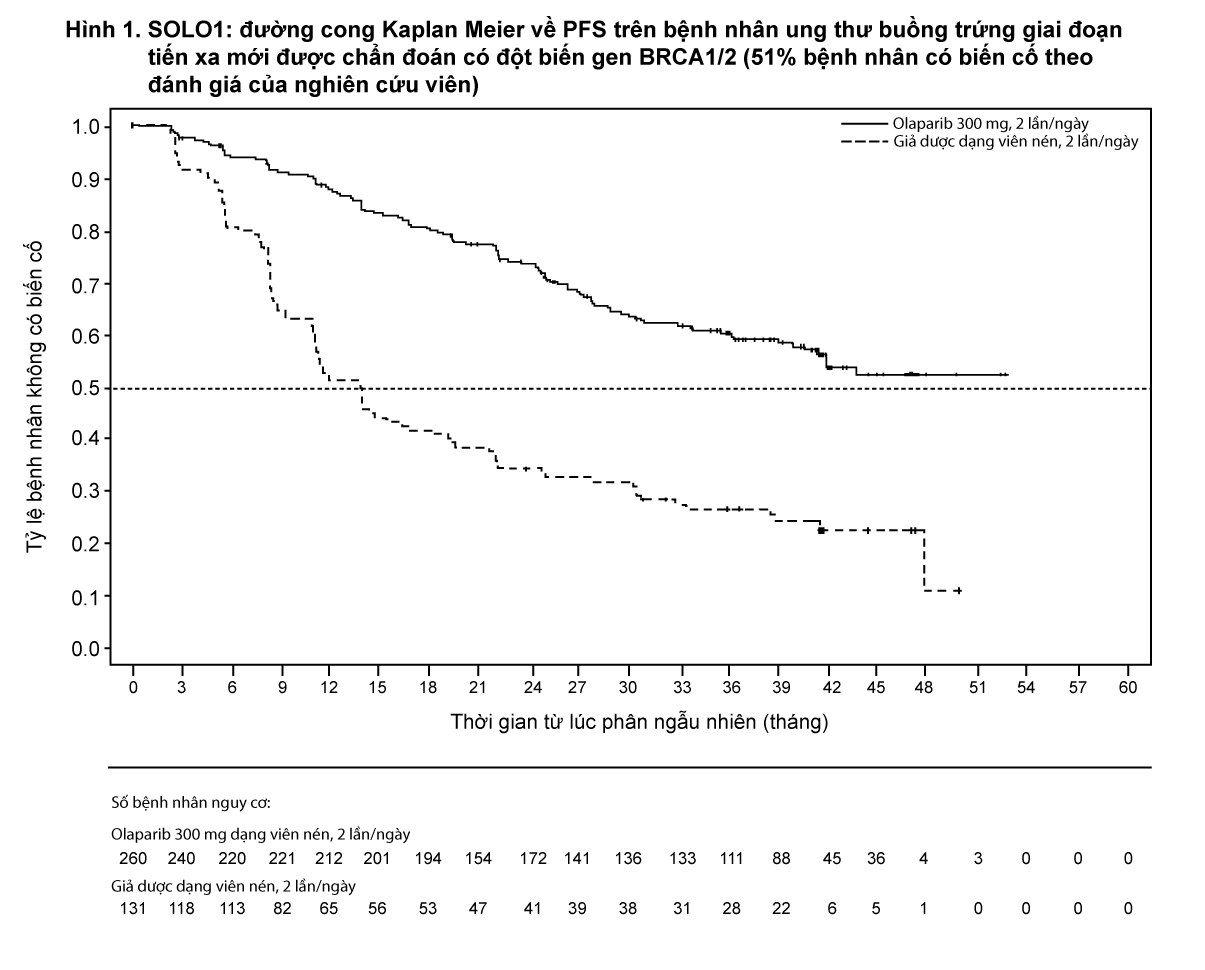
Kết quả nhất quán đã được ghi nhận trong các phân nhóm bệnh nhân có bằng chứng bệnh tại thời điểm tham gia nghiên cứu. Bệnh nhân có đáp ứng hoàn toàn (CR) được xác định bởi nghiên cứu viên có HR 0,34 (khoảng tin cậy 95% 0,24- 0,47); trung vị PFS chưa đạt được ở nhánh olaparib so với 15,3 tháng ở nhánh giả dược. Tại thời điểm 24 và 36 tháng, có 68% và 45% bệnh nhân tương ứng vẫn còn đáp ứng hoàn toàn (CR) ở nhánh olaparib so với 34% và 22% bệnh nhân ở nhánh giả dược. Bệnh nhân đáp ứng một phần (PR) tại thời điểm tham gia nghiên cứu có tỷ số rủi ro HR về PFS là 0,31 (khoảng tin cậy 95% 0,18-0,52; thời gian trung vị PFS là 30,9 tháng trên nhánh olaparib so với 8,4 tháng ở nhánh giả dược). Bệnh nhân có đáp ứng một phần (PR) tại thời điểm tham gia nghiên cứu hoặc là đạt được đáp ứng hoàn toàn (CR) (15% ở nhóm olaparib và 4% ở nhóm giả dược tại thời điểm 24 tháng, vẫn đáp ứng hoàn toàn (CR) tại thời điểm 36 tháng) hoặc là đáp ứng một phần (PR)/ bệnh ổn định (43% ở nhánh olaparib và 15% ở nhánh giả dược tại thời điểm 24 tháng, 17% ở nhánh olaparib và 15% ở nhánh giả dược tại thời điểm 36 tháng). Tỷ lệ bệnh nhân tiến triển trong vòng 6 tháng kể từ khi nhận liều cuối hóa trị có chứa platinum là 3,5% đối với olaparib và 8,4% đối với giả dược.
Điều trị duy trì ung thư buồng trứng tái phát nhạy cảm với platinum (PSR)
Nghiên cứu SOLO2
Tính an toàn và hiệu quả của olaparib khi điều trị duy trì đã được nghiên cứu trong một thử nghiệm pha III, ngẫu nhiên, mù đôi, đối chứng với giả dược trên bệnh nhân ung thư buồng trứng, ống dẫn trứng, hoặc ung thư phúc mạc nguyên phát tái phát nhạy cảm với platinum (PSR), có đột biến BRCA1/2 dạng di truyền (germline). Nghiên cứu đã so sánh hiệu quả của điều trị duy trì bằng Lynparza (300 mg [2 x viên nén 150 mg] hai lần/ngày) dùng cho đến khi bệnh tiến triển với điều trị bằng giả dược trên 295 bệnh nhân ung thư buồng trứng thể thanh dịch hoặc thể nội mạc tử cung độ mô học cao, tái phát nhạy với platinum (PSR) (bệnh nhân được phân ngẫu nhiên dùng thuốc theo tỷ lệ 2:1 gồm có 196 người dùng olaparib và 99 người dùng giả dược) là những bệnh nhân đang có đáp ứng (hoàn toàn hoặc một phần) sau khi hoàn tất hóa trị chứa platinum.
Bệnh nhân được dùng từ hai phác đồ hóa trị chứa platinum trở lên và đã tái phát bệnh > 6 tháng sau khi hoàn tất hóa trị chứa platinum giáp cuối (penultimate platinum based chemotherapy). Bệnh nhân không được nhận các điều trị trước đó với olaparib hoặc thuốc ức chế PARP khác. Bệnh nhân có thể đã dùng bevacizumab trước đó, ngoại trừ trong phác đồ ngay trước khi được phân ngẫu nhiên dùng thuốc trong nghiên cứu.
Tất cả bệnh nhân đã có bằng chứng về đột biến gen BRCA1/2 dạng di truyền (germline) (gBRCA1/2m) tại thời điểm trước nghiên cứu. Bệnh nhân có đột biến BRCA1/2 được xác định từ xét nghiệm đột biến di truyền trong máu qua xét nghiệm tại địa phương hoặc xét nghiệm trung tâm ở Myriad hoặc từ xét nghiệm mẫu khối u tại địa phương. Hiện tượng tái sắp xếp trên diện rộng các gen BRCA1/2 đã được phát hiện ở 4,7% (14/295) trong số các bệnh nhân ngẫu nhiên.
Các đặc điểm nhân trắc học và các thông số trước nghiên cứu nhìn chung rất cân bằng giữa các nhánh olaparib và giả dược. Tuổi trung vị là 56 tuổi ở cả hai nhánh. Ung thư buồng trứng nguyên phát ở > 80% bệnh nhân. Loại mô học phổ biến nhất là thể thanh dịch (> 90%), mô học nội mạc tử cung được ghi nhận ở 6% bệnh nhân. Trong nhánh olaparib, 55% bệnh nhân chỉ dùng 2 bước điều trị trước đó và 45% dùng 3 bước điều trị trở lên. Trong nhóm giả dược, 61% bệnh nhân chỉ dùng 2 bước điều trị trước đó và 39% dùng 3 bước điều trị trở lên. Hầu hết bệnh nhân có chỉ số tổng trạng ECOG bằng 0 (81%), không có dữ liệu trên bệnh nhân có chỉ số tổng trạng từ 2 đến 4. Thời gian ngưng dùng platinum > 12 tháng ở 60% bệnh nhân và > 6-12 tháng ở 40% bệnh nhân. Đáp ứng hoàn toàn với hóa trị chứa platinum trước đó ở 47% bệnh nhân và đáp ứng một phần ở 53% bệnh nhân. Trong nhánh olaparib và giả dược, tỷ lệ bệnh nhân đã dùng bevacizumab trước đó lần lượt là 17% và 20%.
Tiêu chí nghiên cứu chính là thời gian sống bệnh không tiến triển (PFS) được đánh giá bởi nghiên cứu viên theo tiêu chuẩn đánh giá đáp ứng trên bướu đặc RECIST 1.1. Tiêu chí hiệu quả phụ bao gồm thời gian từ khi phân ngẫu nhiên vào nghiên cứu cho đến khi bệnh tiến triển lần 2 hoặc tử vong (PFS2); thời gian sống còn toàn bộ (OS), thời gian từ khi phân ngẫu nhiên vào nghiên cứu cho đến khi ngừng điều trị hoặc tử vong (TDT), thời gian từ khi phân ngẫu nhiên vào nghiên cứu cho đến khi bắt đầu liệu pháp chống ung thư tiếp theo đầu tiên hoặc tử vong (TFST), thời gian từ khi phân ngẫu nhiên vào nghiên cứu cho đến bắt đầu bắt đầu liệu pháp chống ung thư tiếp theo thứ hai hoặc tử vong (TSST); và chất lượng cuộc sống liên quan đến sức khỏe (HRQoL).
Nghiên cứu đã đạt được tiêu chí chính chứng minh sự cải thiện đáng kể có ý nghĩa thống kê về PFS đánh giá bởi nghiên cứu viên trong nhánh dùng olaparib so với giả dược với tỷ số rủi ro (HR) là 0,30 (CI 95% 0,22-0,41; p <0,0001; trung vị 19,1 tháng ở nhánh olaparib so với 5,5 tháng ở nhánh giả dược). Đánh giá của nghiên cứu viên về PFS đã được hỗ trợ bởi đánh giá của Hội đồng độc lập thẩm định mù dựa trên hình ảnh học về PFS (HR 0,25; 95% CI 0,18-0,35; p <0,0001; trung vị 30,2 tháng đối với olaparib và 5,5 tháng đối với giả dược). Sau 2 năm, 43% bệnh nhân được điều trị bằng olaparib vẫn không tiến triển bệnh so với chỉ có 15% bệnh nhân ở nhánh giả dược.
Bảng tóm tắt kết quả tiêu chí nghiên cứu chính trên bệnh nhân ung thư buồng trứng tái phát nhạy cảm với platinum (PSR) có đột biến gen BRCA1/2 dạng di truyền (germline) (gBRCA1/2m) trong nghiên cứu SOLO2 được trình bày trong Bảng 2 và Hình 3.
- xem Bảng 2 và Hình 3.

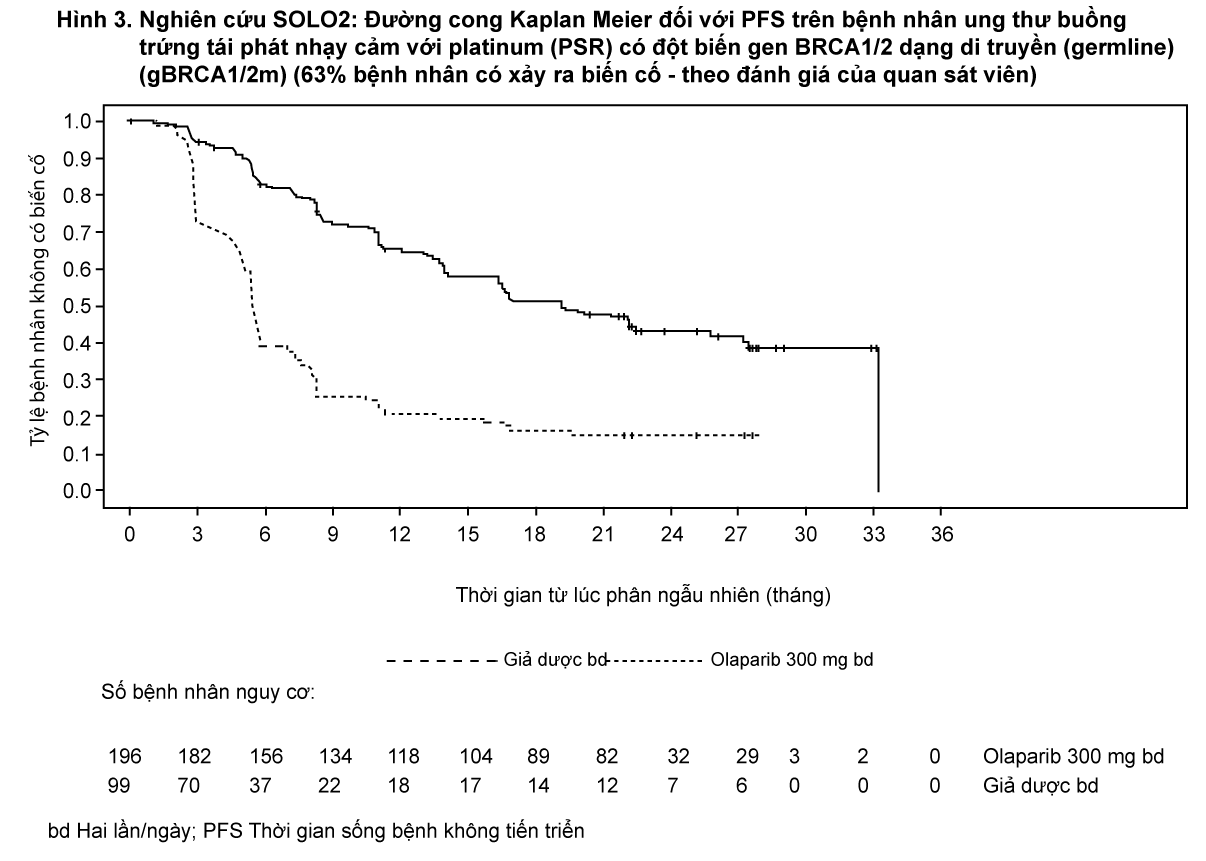
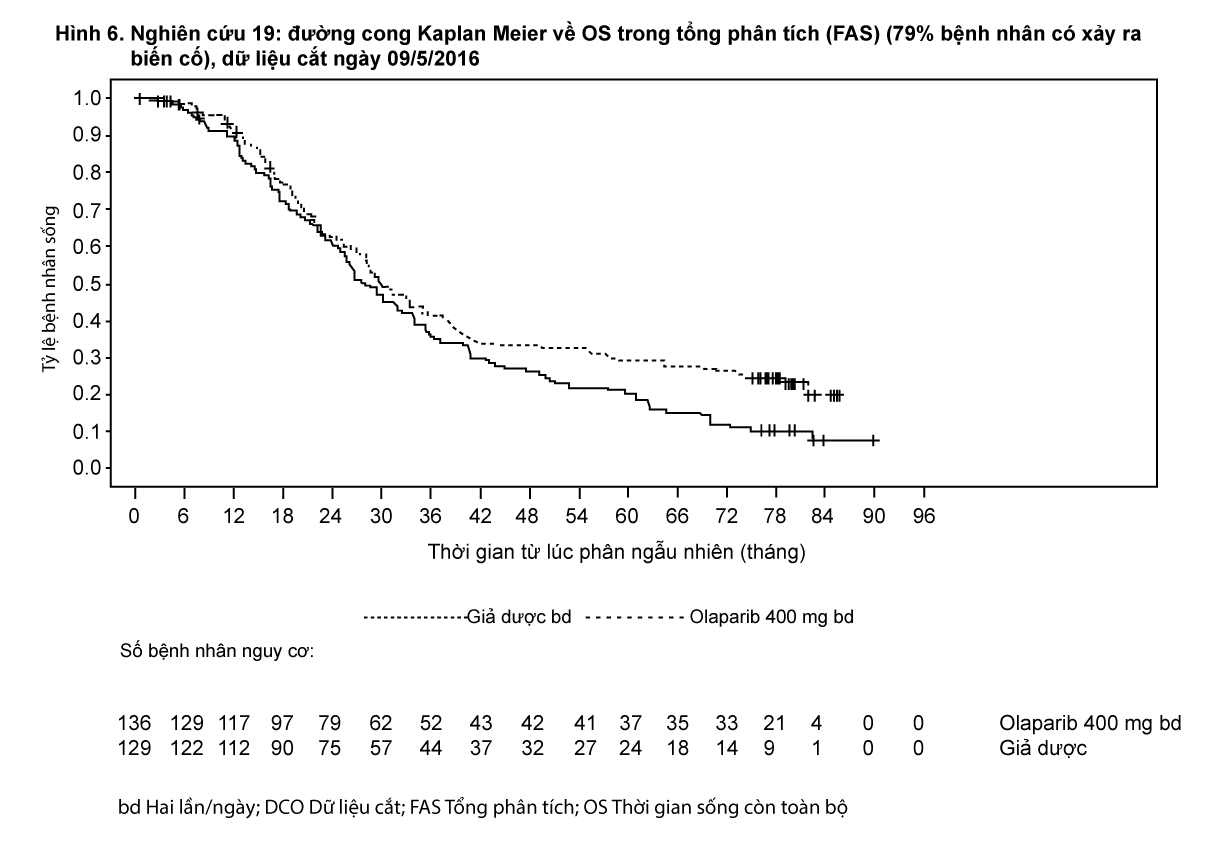
Tại thời điểm phân tích thời gian sống còn toàn bộ (OS) cuối cùng (61% bệnh nhân có xảy ra biến cố) thì HR là 0,74 (95% CI 0,54 - 1,00; p=0,0537; trung vị OS 51,7 tháng ở nhánh olaparib so với 38,8 tháng ở nhánh giả dược) không đạt ý nghĩa thống kê. Các tiêu chí phụ TFST và PFS2 đã chứng minh sự cải thiện đáng kể có ý nghĩa thống kê và bền vững của olaparib so với giả dược. Kết quả về OS, TFST và PFS2 được trình bày trong Bảng 3 và Hình 4.
- xem Bảng 3 và Hình 4.

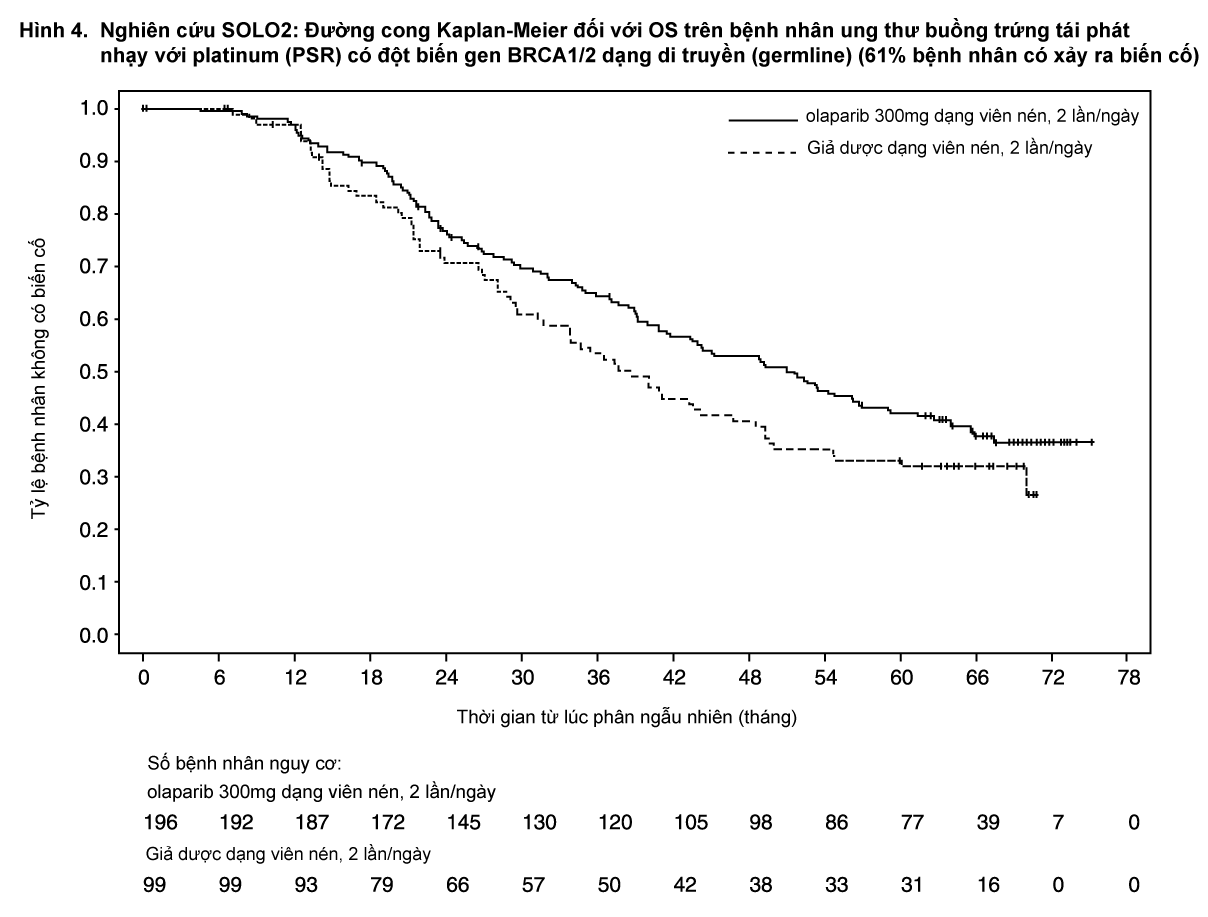
Trong số bệnh nhân tham gia thử nghiệm với tổn thương có thể đo lường được (tổn thương đích ở thời điểm ban đầu), tỷ lệ đáp ứng khách quan đạt được ở nhánh Lynparza là 41% so với tỷ lệ 17% ở nhánh giả dược. Trong số bệnh nhân được điều trị bằng Lynparza, tham gia nghiên cứu có bằng chứng bệnh (tổn thương đích hoặc không tổn thương đích ở thời điểm ban đầu), có 15,0% bệnh nhân đáp ứng hoàn toàn so với 9,1% ở nhóm bệnh nhân dùng giả dược.
Tại thời điểm phân tích PFS, trung vị thời gian điều trị là 19,4 tháng đối với olaparib và 5,6 tháng đối với giả dược. Phần lớn bệnh nhân vẫn dùng liều khởi đầu olaparib 300 mg, 2 lần/ngày. Tỷ lệ ngưng dùng thuốc tạm thời, giảm liều, ngừng thuốc do tác dụng ngoại ý tương ứng là 45,1%; 25,1% và 10,8%. Việc ngưng thuốc tạm thời xảy ra thường xuyên nhất trong 3 tháng đầu và giảm liều trong 3-6 tháng đầu điều trị. Các phản ứng bất lợi thường gặp nhất dẫn đến ngưng dùng thuốc tạm thời hoặc giảm liều là thiếu máu, buồn nôn và nôn.
Dữ liệu kết quả do bệnh nhân ghi nhận (PRO) cho thấy không có sự khác biệt ở bệnh nhân được điều trị bằng olaparib so với giả dược được đánh giá bằng sự thay đổi so với ban đầu theo Chỉ số kết quả thử nghiệm (TOI) của Đánh giá chức năng liệu pháp ung thư - buồng trứng (FACT-O).
Nghiên cứu 19 (D0810C00019)
Tính an toàn và hiệu quả của olaparib như một liệu pháp duy trì trong điều trị ung thư buồng trứng, ung thư ống dẫn trứng hoặc ung thư phúc mạc nguyên phát tái phát nhạy với platinum, sau khi điều trị bằng hai hoặc nhiều phác đồ chứa platinum, đã được nghiên cứu trong một thử nghiệm pha II lớn ngẫu nhiên, mù đôi, đối chứng với giả dược (nghiên cứu 19). Nghiên cứu đã so sánh hiệu quả của việc điều trị duy trì bằng viên nang Lynparza (400 mg [8 x viên nang 50 mg] hai lần mỗi ngày) cho đến khi bệnh tiến triển so với điều trị bằng giả dược trên 265 bệnh nhân ung thư buồng trứng tái phát nhạy cảm với platinum dạng bướu thanh dịch độ mô học cao (high grade serous) là những người đang đáp ứng (hoàn toàn hoặc một phần) sau khi hoàn tất hóa trị liệu có platinum (136 bệnh nhân dùng olaparib và 129 bệnh nhân dùng giả dược). Tiêu chí nghiên cứu chính là PFS dựa trên đánh giá của nghiên cứu viên bằng RECIST 1.0. Tiêu chí hiệu quả phụ bao gồm thời gian sống còn toàn bộ OS, tỷ lệ kiểm soát bệnh (DCR) được xác định là đáp ứng hoàn toàn hoặc một phần và bệnh ổn định (CR/PR + SD), chất lượng cuộc sống liên quan đến sức khỏe (HRQoL) và các triệu chứng liên quan đến bệnh. Các phân tích thăm dò về TFST và TSST cũng đã được thực hiện.
Bệnh nhân đã tái phát bệnh > 6 tháng sau khi hoàn tất hóa trị có platinum giáp cuối (penultimate) được chọn vào nghiên cứu. Việc tuyển bệnh không yêu cầu bằng chứng về tình trạng đột biến gen BRCA1/2 (tình trạng đột biến gen BRCA ở một số bệnh nhân được xác định hồi cứu). Bệnh nhân không thể được điều trị trước đó với olaparib hoặc với thuốc ức chế PARP khác. Bệnh nhân có thể đã điều trị trước với bevacizumab, ngoại trừ trong phác đồ điều trị ngay trước khi được phân ngẫu nhiên vào nghiên cứu này. Không được phép điều trị lại với olaparib sau khi bệnh nhân đã tiến triển với olaparib.
Bệnh nhân có đột biến gen BRCA1/2 hoặc là được xác định từ xét nghiệm đột biến di truyền trong máu qua một xét nghiệm tại địa phương hoặc xét nghiệm trung tâm ở Myriad hoặc từ xét nghiệm mẫu khối u được thực hiện bởi Foundation Medicine. Hiện tượng tái sắp xếp trên diện rộng các gen BRCA1/2 đã được phát hiện ở 7,4% (10/136) trong số bệnh nhân ngẫu nhiên.
Các đặc điểm nhân trắc học và cơ bản nhìn chung rất cân bằng giữa các nhánh olaparib và giả dược. Tuổi trung vị là 59 tuổi ở cả hai nhánh. Ung thư buồng trứng nguyên phát chiếm tỷ lệ 86% bệnh nhân. Trong nhánh olaparib, có 44% bệnh nhân chỉ dùng 2 bước điều trị trước đó, 56% bệnh nhân đã nhận được 3 bước điều trị trở lên. Trong nhánh giả dược, 49% bệnh nhân chỉ dùng 2 bước điều trị trước đó và 51% dùng 3 bước điều trị trở lên. Hầu hết bệnh nhân (77%) có chỉ số tổng trạng theo ECOG bằng 0, không có dữ liệu trên bệnh nhân có chỉ số tổng trạng từ 2 đến 4. Thời gian ngưng dùng hóa trị chứa platinum > 12 tháng ở 60% bệnh nhân và > 6-12 tháng ở 40% bệnh nhân. 45% bệnh nhân đã đáp ứng hoàn toàn với hóa trị chứa platinum trước đó và 55% bệnh nhân đáp ứng một phần. Trong nhánh olaparib và giả dược, tỷ lệ bệnh nhân đã dùng bevacizumab trước đó lần lượt là 6% và 5%.
Nghiên cứu đã đạt được tiêu chí chính chứng minh sự cải thiện đáng kể có ý nghĩa thống kê về PFS ở nhánh olaparib so với giả dược trong tổng dân số với HR là 0,35 (95% CI 0,25-0,49; p <0,00001; trung vị 8,4 tháng ở nhánh olaparib so với 4,8 tháng ở nhánh giả dược). Tại thời điểm phân tích thời gian sống còn toàn bộ OS cuối cùng (dữ liệu cắt [data cut-off DCO] vào ngày 9 tháng 5 năm 2016) có 79% bệnh nhân xảy ra biến cố, tỷ số rủi ro so sánh olaparib với giả dược là 0,73 (95% CI 0,55-0,95; p = 0,02138 [không đạt mức có ý nghĩa thống kê được định trước < 0,0095]; trung vị 29,8 tháng ở nhánh olaparib so với 27,8 tháng ở nhánh giả dược). Trong nhánh được điều trị bằng olaparib, có 23,5% (n = 32/136) bệnh nhân duy trì điều trị trong ≥ 2 năm so với chỉ có 3,9% (n = 5/128) bệnh nhân ở nhánh dùng giả dược. Mặc dù số lượng bệnh nhân bị hạn chế, 13,2% (n = 18/136) bệnh nhân trong nhánh olaparib vẫn duy trì điều trị 5 năm so với 0,8% (n = 1/128) trong nhóm giả dược.
Phân tích phân nhóm được lập kế hoạch trước đã xác định bệnh nhân ung thư buồng trứng có đột biến gen BRCA1/2 (n=136, 51,3%; bao gồm 20 bệnh nhân được xác định có đột biến gen BRCA1/2 dạng mắc phải (somatic) trên khối u) là phân nhóm có được lợi ích lâm sàng lớn nhất từ điều trị duy trì đơn trị olaparib. Lợi ích lâm sàng dù ít cũng được ghi nhận trên bệnh nhân có BRCA1/2 thể hoang dại (wild type) hoặc các biến thể chưa chắc chắn (variants of uncertain significance) (BRCA1/2 wt/VUS). Không có chiến lược xét nghiệm nhiều lần cho các phân tích phân nhóm.
Tóm tắt về kết quả tiêu chí chính cho bệnh nhân ung thư buồng trứng tái phát nhạy cảm với platinum (PSR), có đột biến gen BRCA1/2 và BRCA1/2 wt/VUS trong nghiên cứu 19 được trình bày tại Bảng 4 và tóm tắt cho tất cả bệnh nhân trong nghiên cứu 19 tại Bảng 4 và Hình 5.
- xem Bảng 4 và Hình 5.

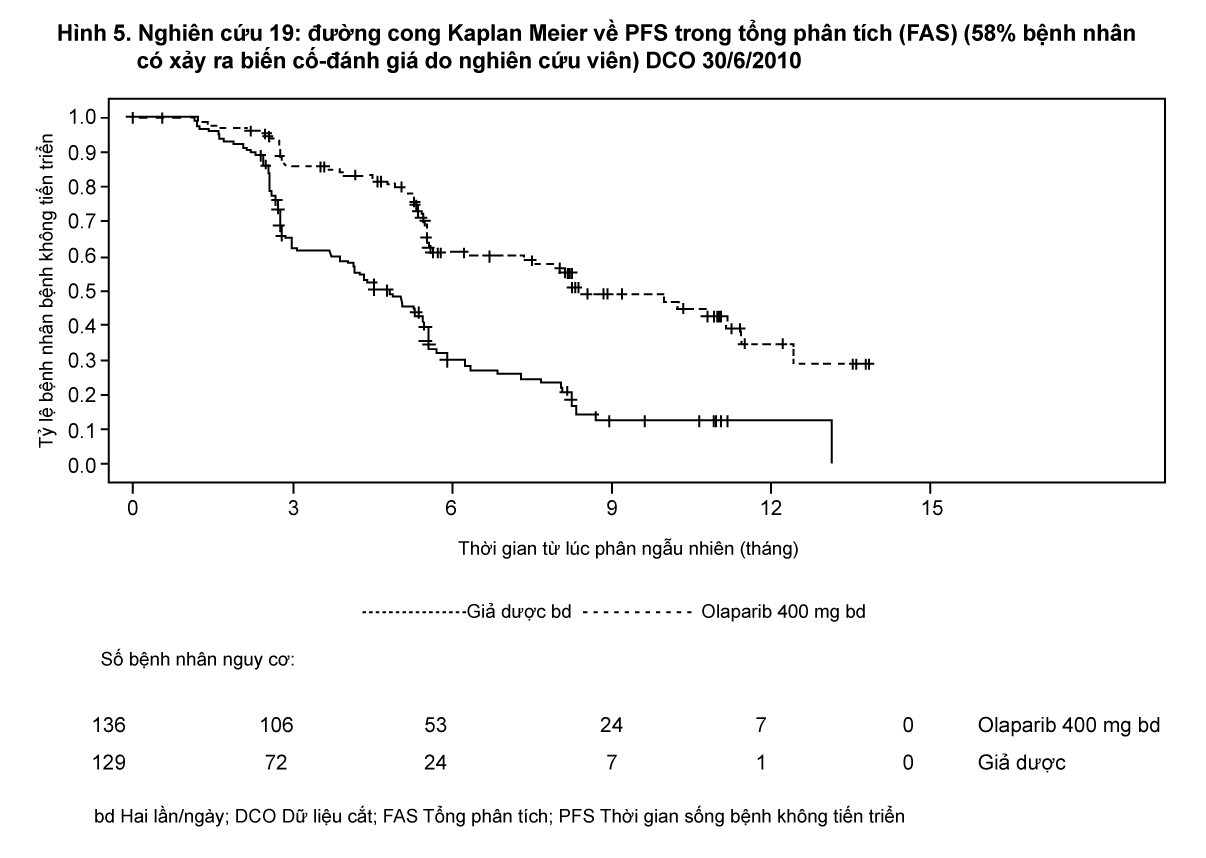
Tóm tắt về kết quả tiêu chí phụ trên bệnh nhân ung thư buồng trứng tái phát nhạy cảm với platinum (PSR), có đột biến gen BRCA1/2 và BRCA1/2 wt/VUS trong nghiên cứu 19 được trình bày tại Bảng 5 và tóm tắt trên tất cả bệnh nhân trong nghiên cứu 19 tại Bảng 5 và Hình 6.
- xem Bảng 5 và Hình 6.

Tại thời điểm phân tích PFS, trung vị thời gian điều trị là 8 tháng đối với olaparib và 4 tháng đối với giả dược. Phần lớn bệnh nhân vẫn duy trì olaparib liều khởi đầu 400 mg, hai lần/ngày. Tần xuất ngưng dùng tạm thời, giảm liều, ngưng thuốc vĩnh viễn do biến cố ngoại ý tương ứng là 34,6%; 25,7% và 5,9%. Việc ngưng dùng tạm thời và giảm liều xảy ra thường xuyên nhất trong 3 tháng đầu điều trị. Các phản ứng ngoại ý thường gặp nhất dẫn đến ngưng dùng tạm thời hoặc giảm liều là buồn nôn, thiếu máu, nôn, giảm bạch cầu trung tính và mệt mỏi. Tần xuất gặp phản ứng ngoại ý thiếu máu là 22,8% (CTCAE cấp độ ≥ 3 chiếm tỷ lệ 7,4%).
Kết quả do bệnh nhân ghi nhận (PRO) cho thấy không có sự khác biệt đối với nhánh điều trị bằng olaparib so với giả dược khi đo lường về tỷ lệ cải thiện và xấu đi theo Chỉ số kết quả thử nghiệm (TOI) và tổng điểm Đánh giá chức năng liệu pháp ung thư - buồng trứng (FACT-O total).
Điều trị duy trì bước 1 trên ung thư buồng trứng giai đoạn tiến xa có HRD dương tính
Nghiên cứu PAOLA-1
PAOLA-1 là một thử nghiệm pha III đa trung tâm, ngẫu nhiên, mù đôi, đối chứng với giả dược, so sánh an toàn và hiệu quả giữa nhóm dùng phối hợp Lynparza (300 mg [2 x viên nén 150 mg], hai lần mỗi ngày) với bevacizumab (15 mg/kg cân nặng, truyền tĩnh mạch mỗi 3 tuần) với nhóm giả dược và bevacizumab trong điều trị duy trì ung thư biểu mô buồng trứng độ mô học cao, ung thư ống dẫn trứng hoặc ung thư phúc mạc nguyên phát ở giai đoạn tiến xa (FIGO giai đoạn III và IV) sau khi hoàn tất hóa trị liệu bước 1 có chứa platinum kết hợp với bevacizumab. Tổng thời gian điều trị bằng bevacizumab tối đa 15 tháng/22 chu kỳ, bao gồm thời gian điều trị phối hợp với hóa trị và duy trì sau đó.
Nghiên cứu chọn ngẫu nhiên 806 bệnh nhân (phân ngẫu nhiên theo tỷ lệ 2:1 bao gồm 537 bệnh nhân dùng olaparib/bevacizumab: 269 dùng giả dược/bevacizumab), những bệnh nhân này không có bằng chứng bệnh (NED) do phẫu thuật cắt bỏ hoàn toàn, hoặc bệnh nhân có đáp ứng hoàn toàn (CR), hay đáp ứng một phần (PR) sau khi hoàn tất hóa trị liệu bước 1 có chứa platinum kết hợp với bevacizumab. Bệnh nhân đã hoàn tất ít nhất 4 chu kỳ và nhiều nhất 9 chu kỳ, với đa số (63%) nhận được 6 chu kỳ hóa trị liệu bước 1 có chứa platinum, bao gồm ít nhất 2 chu kỳ bevacizumab kết hợp trong 3 chu kỳ hóa trị cuối cùng. Số chu kỳ trung vị của bevacizumab trước khi phân ngẫu nhiên vào nghiên cứu là 5.
Bệnh nhân được phân tầng dựa trên hiệu quả điều trị bước 1 (thời gian và hiệu quả của phẫu thuật giảm tổng khối u và đáp ứng với hóa trị liệu chứa platinum) và tình trạng đột biến gen BRCA trên khối u (tBRCAm) được xác định tiến cứu từ xét nghiệm tại địa phương. Bệnh nhân tiếp tục điều trị duy trì với bevacizumab và bắt đầu điều trị bằng Lynparza sau 3 tuần và đến 9 tuần kể từ lúc hoàn tất liều cuối cùng của hóa trị liệu. Tiếp tục điều trị với Lynparza cho đến khi bệnh tiến triển, độc tính không thể chấp nhận được hoặc cho đến 2 năm. Bệnh nhân mà theo ý kiến của bác sĩ điều trị có thể thu được lợi ích nhiều hơn khi được điều trị tiếp tục thì có thể được điều trị hơn 2 năm.
Các đặc điểm nhân trắc học và trước khi điều trị được cân bằng giữa hai nhánh trong nhóm dân số dự định điều trị (ITT) và trong các phân nhóm dấu ấn sinh học theo tình trạng đột biến gen BRCA trên khối u (xác định bởi tiền cứu và hồi cứu), chỉ số thang điểm bất ổn định bộ gen (GIS) và suy giảm chức năng tái tổ hợp tương đồng (HRD) (trong nghiên cứu này được xác định bằng sự kết hợp cả hai dấu ấn sinh học). Tuổi trung vị của bệnh nhân nói chung là 61 tuổi. Hầu hết bệnh nhân có chỉ số tổng trạng ECOG bằng 0 (70%). Ung thư buồng trứng nguyên phát ở 86% bệnh nhân. Loại mô học phổ biến nhất là thể thanh dịch (96%) và mô học nội mạc tử cung được ghi nhận ở 2% bệnh nhân. Hầu hết bệnh nhân được chẩn đoán giai đoạn FIGO IIIC (63%). Tất cả bệnh nhân đã được điều trị bước 1 với hóa trị liệu chứa platinum và bevacizumab. 63% đạt được giảm tổng khối bướu hoàn toàn ở lần phẫu thuật đầu tiên hoặc phẫu thuật giảm tổng khối bướu giữa kỳ và 37% có bệnh tồn dư đại thể. 30% bệnh nhân ở cả hai nhánh được sàng lọc có đột biến tBRCA. Các đặc điểm nhân trắc học và trước khi điều trị trong các phân nhóm dấu ấn sinh học nhất quán với nhóm dân số dự định điều trị (ITT). Trong phân nhóm có HRD dương tính, 65% bệnh nhân được phẫu thuật giảm tổng khối bướu hoàn toàn và 35% bệnh nhân có bệnh tồn dư đại thể. Trong tổng dân số bệnh nhân, thông qua xét nghiệm tại địa phương đã sàng lọc 30% bệnh nhân ở cả hai nhánh có đột biến tBRCA [đột biến nguy hiểm (deleterious)/ gây bệnh (likely pathogenic)] và 4% bệnh nhân không rõ về tình trạng đột biến BRCA. Thực hiện phân tích hồi cứu trên các mẫu bệnh lâm sàng có sẵn, đã được thực hiện trên 97% bệnh nhân để xác nhận tình trạng đột biến tBRCA và xét nghiệm thời điểm bất ổn định bộ gen (genomic instability) theo mô tả như trên. Ở nghiên cứu này, trong các bệnh nhân không có đột biến tBRCA, 29% (19% tổng dân số) có điểm số bất ổn định bộ gen (GIS) dương tính được xác định, với tổng điểm kết hợp là ≥ 42. Khi kết hợp tình trạng đột biến tBRCA với GIS dương tính, thì tỷ lệ bệnh nhân có HRD dương tính, HRD âm tính và không rõ tình trạng HRD hiện diện trong khối bướu lần lượt là 48%, 34% và 18% trên tổng dân số bệnh nhân.
Tiêu chí nghiên cứu chính là thời gian sống bệnh không tiến triển (PFS) được xác định là thời gian từ khi phân ngẫu nhiên vào nghiên cứu cho đến khi bệnh tiến triển, đánh giá bởi nghiên cứu viên, sử dụng tiêu chí đánh giá đáp ứng trên bướu đặc (RECIST) 1.1 cải tiến hoặc tử vong. Tiêu chí hiệu quả phụ bao gồm thời gian từ khi phân ngẫu nhiên vào nghiên cứu đến khi bệnh tiến triển lần thứ hai hoặc tử vong (PFS2), thời gian sống còn toàn bộ (OS), thời gian từ khi phân ngẫu nhiên vào nghiên cứu cho đến khi bắt đầu điều trị phác đồ kháng ung thư tiếp theo hoặc tử vong (TFST) và chất lượng cuộc sống liên quan đến sức khỏe (HRQoL). Bệnh nhân được đánh giá khối u theo tiêu chí RECIST 1.1 trước khi tham gia nghiên cứu và sau mỗi 24 tuần (chụp CT/MRI tại tuần thứ 12 nếu có tiến triển trên lâm sàng hoặc trên chỉ số CA-125) đến 42 tháng hoặc cho đến khi có bệnh tiến triển khách quan trên hình ảnh học.
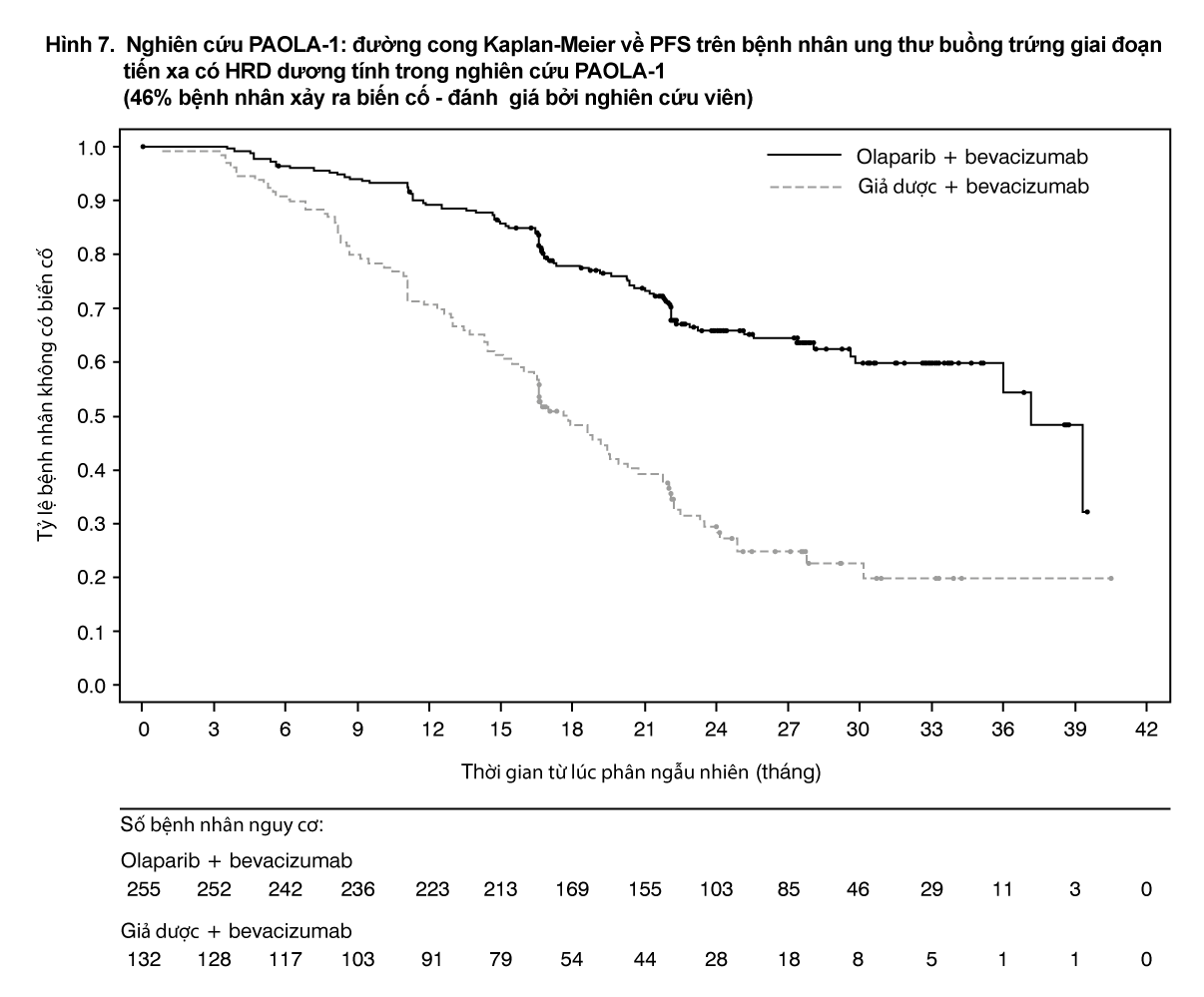
Nghiên cứu đã đạt được tiêu chí chính trong nhóm dân số dự định điều trị (ITT), chứng minh sự cải thiện đáng kể có ý nghĩa thống kê về PFS đánh giá bởi nghiên cứu viên ở nhánh dùng olaparib/bevacizumab so với giả dược/bevacizumab (với tỷ số rủi ro HR là 0,59; 95% CI 0,49-0,72, p<0,0001; trung vị 22,1 tháng ở nhánh olaparib/bevacizumab so với 16,6 tháng ở nhánh giả dược/bevacizumab). Kết quả này nhất quán với phân tích về PFS đánh giá bởi Hội đồng độc lập thẩm định mù trên hình ảnh học (BICR). Tuy nhiên, bệnh nhân được xác định có dấu ấn sinh học dương tính (đột biến tBRCA, GIS, tình trạng HRD dương tính xác định bằng đột biến tBRCA và/hoặc GIS dương tính) có được lợi ích lớn nhất. Dữ liệu sống còn toàn bộ chưa hoàn thiện trong tổng số dân và phân nhóm có dấu ấn sinh học.
Trong phân nhóm có đột biến tBRCA được phân ngẫu nhiên (241/806 bệnh nhân), trung vị PFS ở nhánh olaparib/bevacizumab là 37,2 tháng so với 22,0 tháng ở nhánh giả dược/bevacizumab (HR=0,34, 95% CI 0,23;0,51) và sống còn toàn bộ (OS) với HR là 0,66 (95% CI 0,37; 1,21).
Kết quả về hiệu quả ở các phân nhóm dấu ấn sinh học khác được phân tích hồi cứu trên trên mẫu khối u được trình bày trong Bảng 6.
- xem Bảng 6 và Hình 7.

Ung thư vú di căn với HER2 âm tính có đột biến gen BRCA1/2 dạng di truyền (germline)
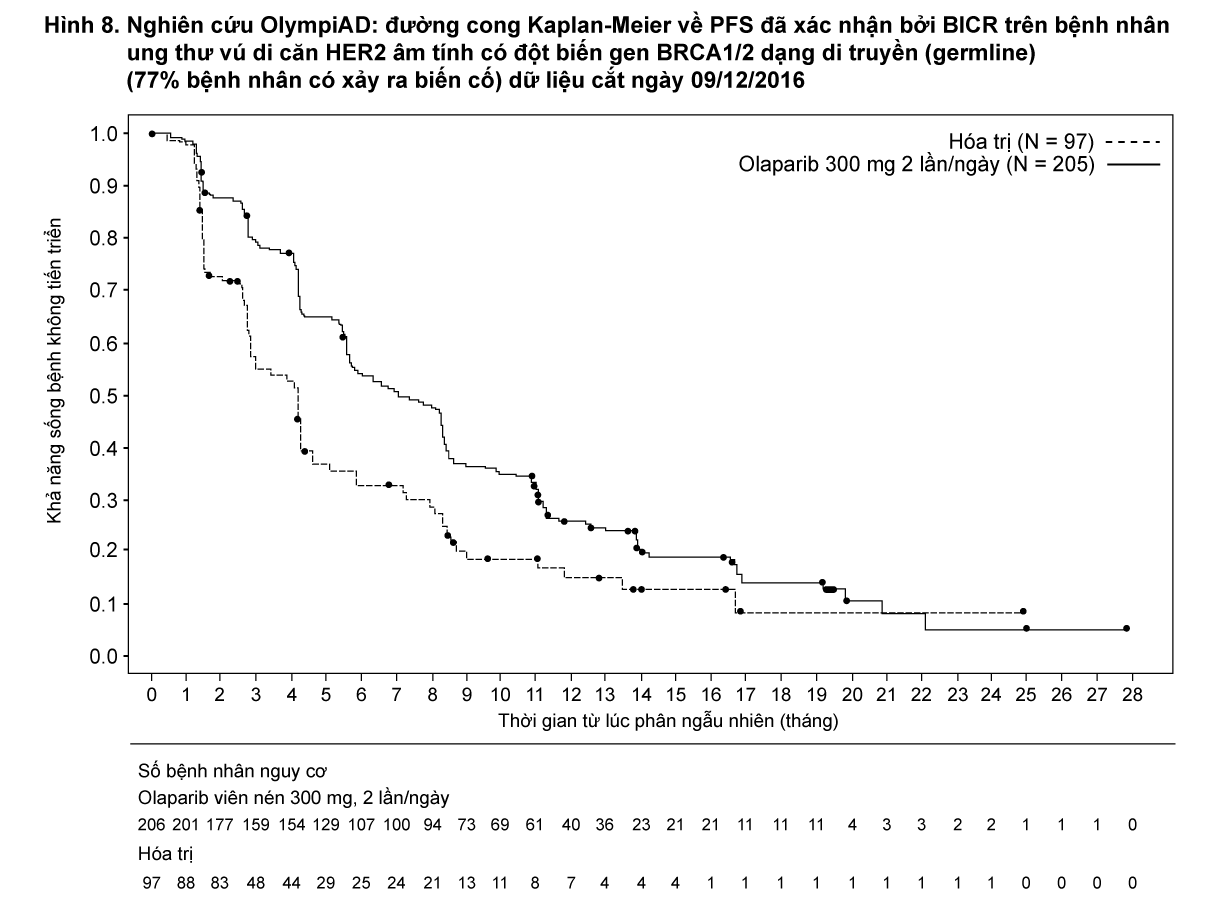
Nghiên cứu OlympiAD (D0819C00003)
Tính an toàn và hiệu quả của olaparib ở những bệnh nhân bị ung thư vú di căn HER2 âm tính, có đột biến gen BRCA1/2 dạng di truyền (germline) đã được nghiên cứu trong thử nghiệm pha III, ngẫu nhiên, nhãn mở, có đối chứng (OlympiAD). Trong nghiên cứu này, 302 bệnh nhân có dữ liệu đột biến gen BRCA dạng di truyền (germline) nguy hiểm hoặc nghi ngờ nguy hiểm, được phân ngẫu nhiên theo tỷ lệ 2:1 dùng Lynparza (300 mg [2 x viên nén 150 mg] hai lần mỗi ngày) hoặc hóa trị theo lựa chọn của bác sĩ (capecitabine 42%, eribulin 35%, hoặc vinorelbine 17%) cho đến khi bệnh tiến triển hoặc xuất hiện độc tính không thể chấp nhận. Bệnh nhân có đột biến BRCA1/2 được xác định từ xét nghiệm đột biến di truyền trong máu qua xét nghiệm tại địa phương hoặc bằng xét nghiệm trung tâm ở Myriad. Bệnh nhân được phân tầng dựa trên: đã dùng các phác đồ hóa trị trước đó cho ung thư vú di căn (có/không), có thụ thể nội tiết (HR) dương tính so với ung thư vú tam âm (triple negative breast cancer – TNBC), điều trị ung thư vú bằng platinum trước đó (có/không). Tiêu chí chính là PFS được đánh giá bởi Hội đồng độc lập thẩm định mù (BICR) theo tiêu chuẩn RECIST 1.1. Các tiêu chí phụ bao gồm thời gian từ khi phân ngẫu nhiên cho đến khi tái phát bệnh lần 2 hoặc tử vong (PFS2), thời gian sống còn toàn bộ (OS), tỷ lệ đáp ứng khách quan (ORR) và chất lượng cuộc sống liên quan đến sức khỏe (HRQoL).
Bệnh nhân phải được điều trị bằng anthracycline trừ khi chống chỉ định và taxan trong bối cảnh điều trị (tân) bổ trợ hoặc di căn. Bệnh nhân có khối u dương tính với thụ thể nội tiết (HR+) (ER và/ hoặc PgR dương tính) phải nhận điều trị và tiến triển với ít nhất một liệu pháp nội tiết (bổ trợ hoặc di căn) hoặc có tình trạng bệnh mà bác sĩ điều trị cho là không phù hợp với liệu pháp nội tiết. Điều trị trước đây với platinum được cho phép trong bối cảnh di căn miễn là không có bằng chứng về tiến triển bệnh khi đang điều trị với platinum và trong bối cảnh (tân) bổ trợ miễn là liều cuối cùng đã được dùng ít nhất 12 tháng trước khi phân ngẫu nhiên vào nghiên cứu. Không được phép điều trị trước với chất ức chế PARP, kể cả olaparib.
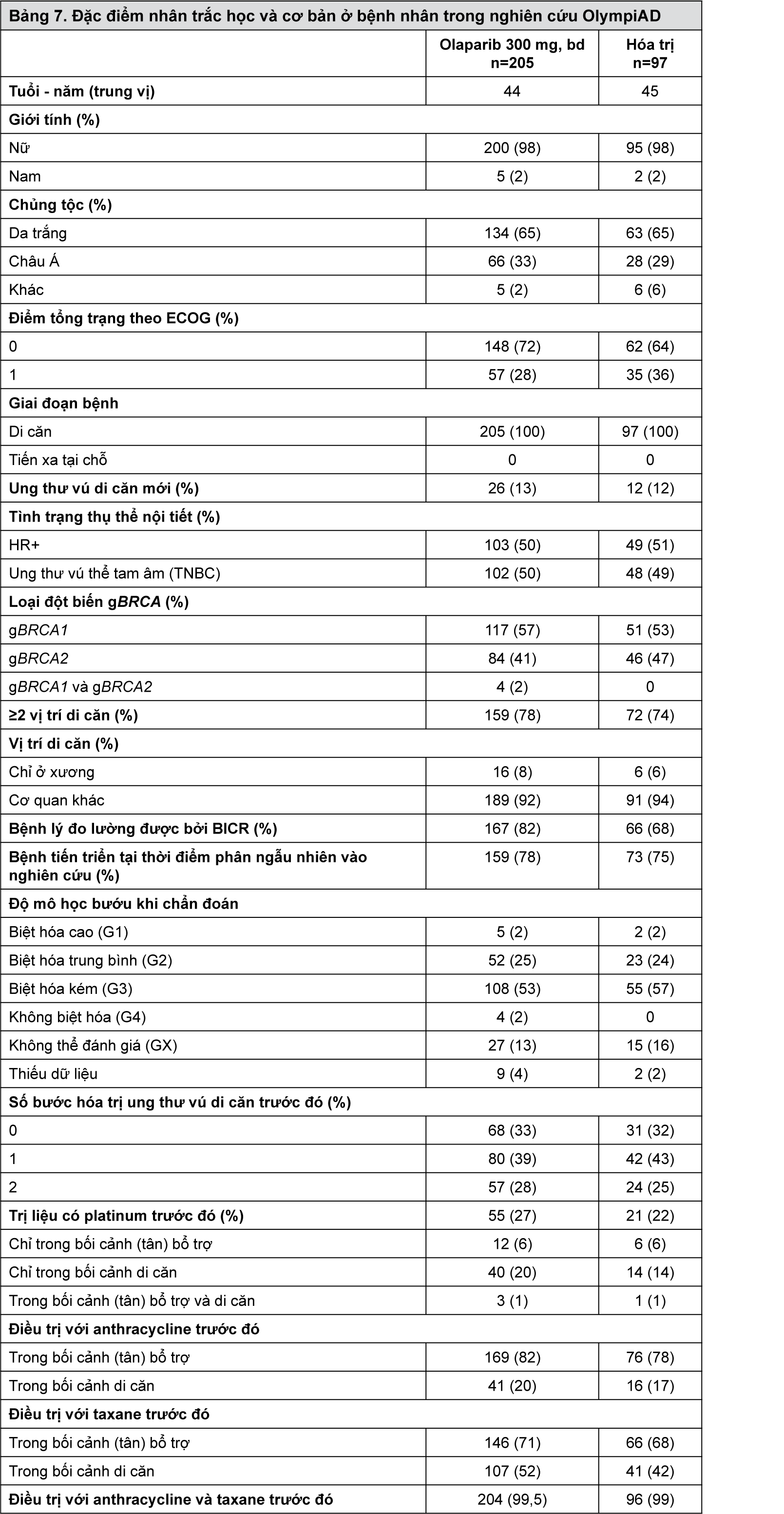
Các đặc điểm nhân trắc học và các thông số trước nghiên cứu nhìn chung rất cân bằng giữa các nhánh so sánh và olaparib.
- xem Bảng 7.
Như liệu pháp tiếp theo, có 0,5% và 8% bệnh nhân dùng chất ức chế PARP tương ứng ở nhánh điều trị và nhánh so sánh; có 29% và 42% bệnh nhân tương ứng được điều trị tiếp theo với platinum.
Sự cải thiện đáng kể có ý nghĩa thống kê về PFS, tiêu chí hiệu quả chính, được chứng minh ở những bệnh nhân được điều trị bằng olaparib so với những bệnh nhân ở nhánh so sánh.
- xem Bảng 8 và Hình 8.

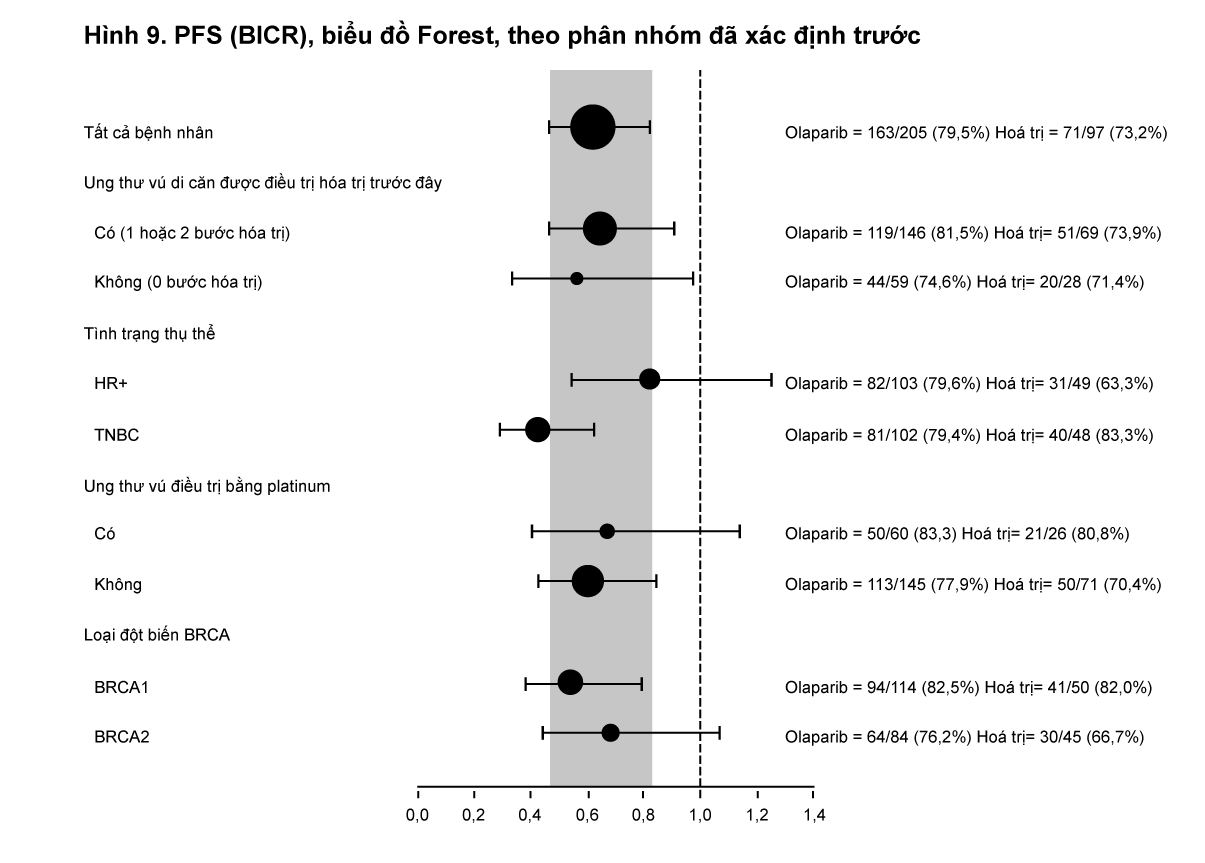
Kết quả nhất quán được quan sát thấy trong tất cả các phân nhóm bệnh nhân được xác định trước (xem Hình 9). Phân tích phân nhóm cho thấy lợi ích PFS của olaparib so với nhóm so sánh trên phân nhóm bệnh nhân ung thư vú tam âm (TNBC) (HR 0,43; 95% CI: 0,29-0,63, n = 152) và phân nhóm bệnh nhân ung thư vú có thụ thể HR+ (HR 0,82; 95% CI: 0,55-1,26, n = 150).
- xem Hình 9.
Trong một phân tích hậu kiểm về phân nhóm bệnh nhân không tiến triển khi dùng hóa trị không chứa platinum, trung vị PFS ở nhánh olaparib (n = 22) là 8,3 tháng (95% CI 3,1-16,7) và 2,8 tháng (95% CI 1,4-4,2) trong nhánh hóa trị liệu (n = 16) với HR là 0,54 (95% CI 0,24-1,23). Tuy nhiên, số lượng bệnh nhân quá hạn chế để đưa ra kết luận có ý nghĩa về hiệu quả trên phân nhóm này.
Bảy bệnh nhân nam được chọn ngẫu nhiên (5 ở nhánh olaparib và 2 ở nhánh so sánh). Tại thời điểm phân tích PFS, 1 bệnh nhân đã có đáp ứng một phần được xác nhận với thời gian đáp ứng là 9,7 tháng ở nhánh olaparib. Không có đáp ứng được xác nhận trong nhánh so sánh.
- xem Hình 10.
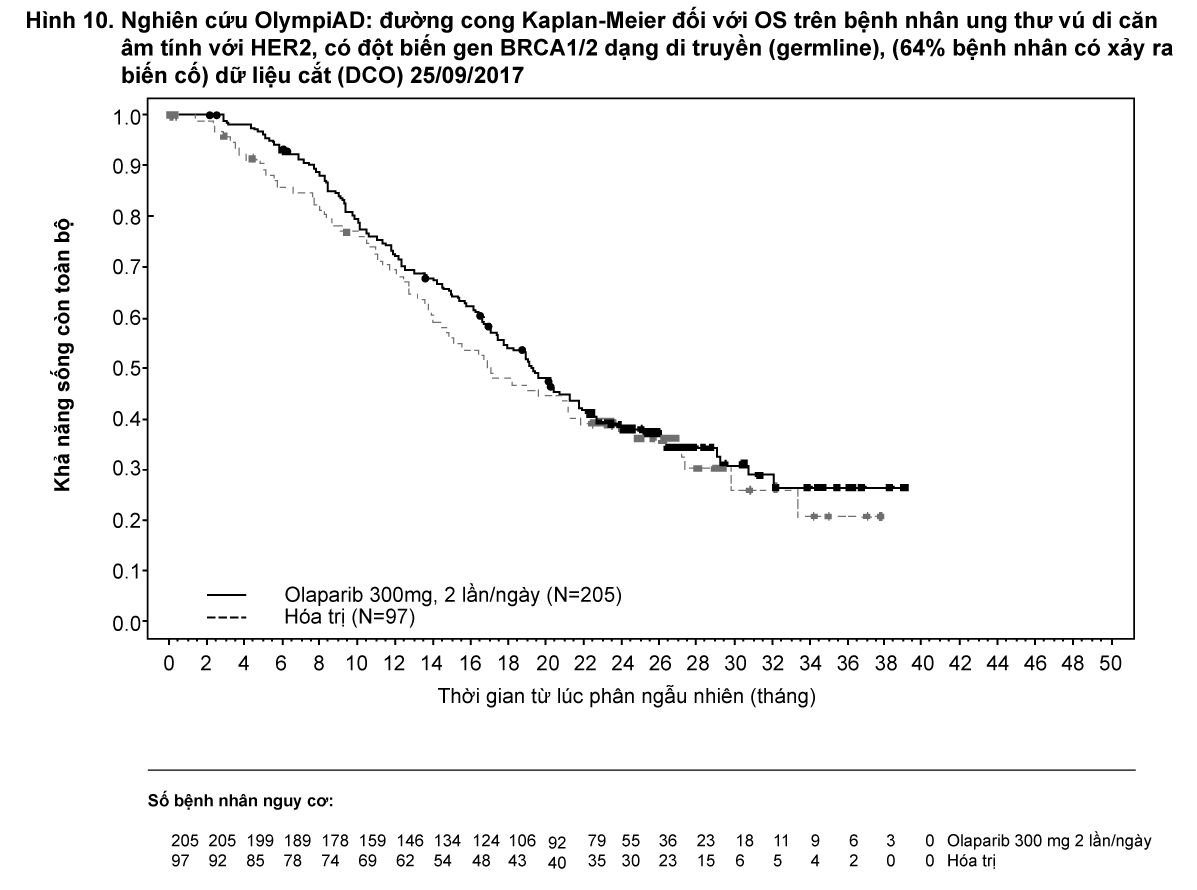
Phân tích về OS ở những bệnh nhân không có hóa trị liệu trước đó cho ung thư vú di căn cho thấy lợi ích trên những bệnh nhân này với HR 0,45 (95% CI 0,27-0,77), trong khi đối với các bước trị liệu tiếp theo HR > 1.
Điều trị duy trì bước 1 trên ung thư biểu mô tuyến tụy giai đoạn di căn có đột biến gen BRCA dạng di truyền (germline)
Nghiên cứu POLO
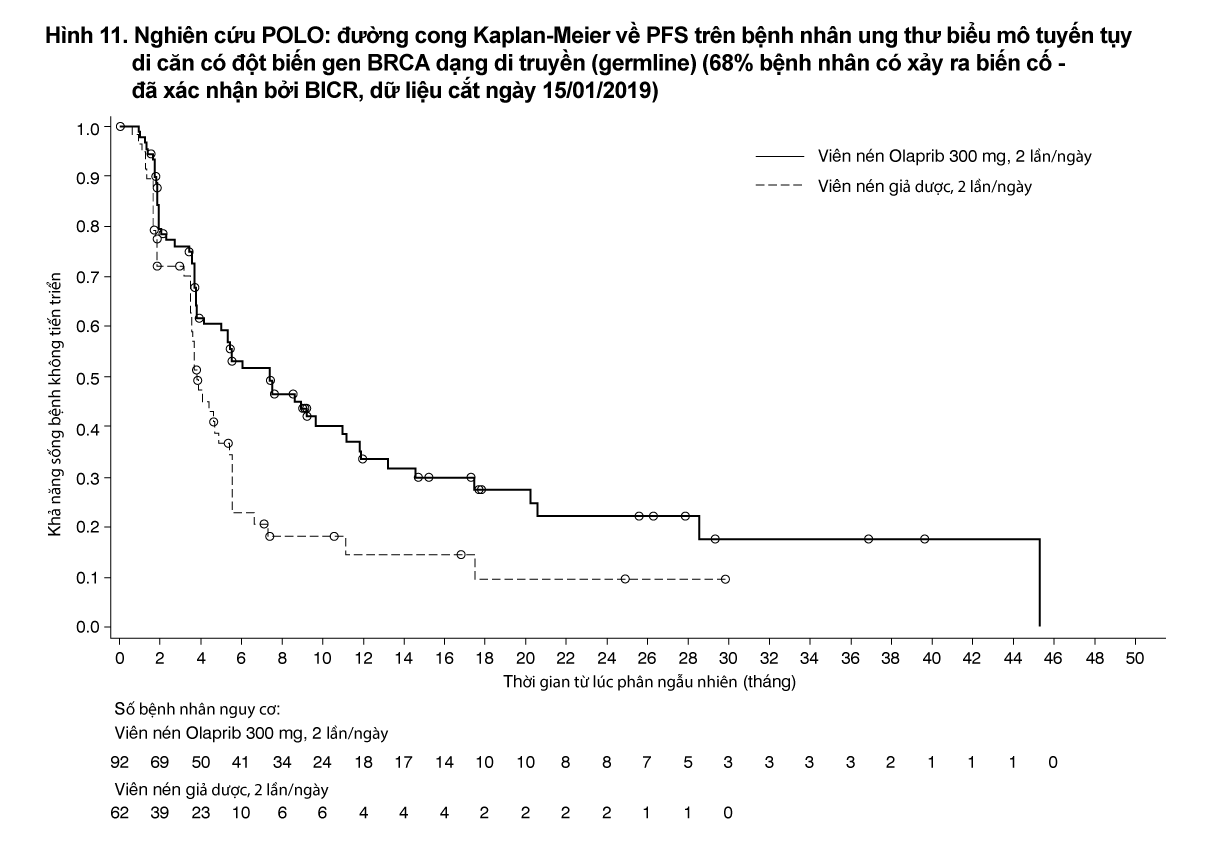
Tính an toàn và hiệu quả của olaparib khi điều trị duy trì đã được nghiên cứu trong một thử nghiệm ngẫu nhiên (theo tỷ lệ 3:2), mù đôi, đối chứng với giả dược, đa trung tâm trên 154 bệnh nhân ung thư biểu mô tuyến tụy giai đoạn di căn có đột biến BRCA1/2 dạng di truyền (germline). Bệnh nhân được cho dùng Lynparza (300 mg [2 x viên nén 150 mg] hai lần mỗi ngày (n=92) hoặc giả dược (n=62) cho đến khi bệnh tiến triển phát hiện trên hình ảnh học hoặc xuất hiện độc tính không thể chấp nhận. Bệnh nhân không tiến triển bệnh trong thời gian điều trị hóa trị liệu bước 1 có chứa platinum và nên được điều trị platinum liên tục tối thiểu 16 tuần, platinum có thể ngừng điều trị bất cứ lúc nào sau đó do độc tính không thể chấp nhận được và tiếp tục bị điều trị các thuốc khác theo phác đồ được lập kế hoạch trước hoặc độc tính không thể chấp nhận do các thành phần khác. Những bệnh nhân có thể dung nạp hoàn toàn phác đồ điều trị hóa trị liệu có chứa platinum cho đến khi tiến triển bệnh không được xem xét tham gia nghiên cứu này. Bắt đầu liệu pháp điều trị duy trì từ 4 đến 8 tuần kể từ liều cuối cùng hóa trị liệu bước 1 trong trường hợp không tiến triển bệnh và nếu có tất cả độc tính do các liệu pháp chống ung thư trước đó cải thiện về cấp độ 1 theo tiêu chuẩn đánh giá các biến cố bất lợi - CTCAE, ngoại trừ rụng tóc, biến chứng viêm dây thần kinh ngoại biên cấp độ 3 và Hgb ≥ 9 g/dL.
31% bệnh nhân có đột biến gen BRCA1/2 dạng di truyền (germline) được xác định từ kết quả xét nghiệm tại địa phương trước đó và 69% bệnh nhân xác định từ xét nghiệm trung tâm. Ở nhánh olaparib, 32% bệnh nhân có đột biến BRCA1 dạng di truyền (germline), 64% đột biến BRCA2 dạng di truyền và 1% có cả đột biến BRCA1 dạng di truyền và BRCA2 dạng di truyền. Ở nhánh giả dược, 26% bệnh nhân có đột biến BRCA1 dạng di truyền, 73% đột biến BRCA2 dạng di truyền và không có bệnh nhân có cả đột biến BRCA1 và BRCA2 dạng di truyền. Tình trạng đột biến gen BRCA của tất cả bệnh nhân được xác định qua kết quả xét nghiệm tại địa phương và nếu có gửi mẫu đã được xác nhận lại bằng xét nghiệm trung tâm. 98% bệnh nhân có đột biến dạng nguy hiểm (deleterious) và 2% có đột biến nghi ngờ nguy hiểm (suspected deleterious). Có 5,2% (8/154) trong số các bệnh nhân phân ngẫu nhiên xuất hiện tái sắp xếp đoạn lớn (large rearrangements) trên các gen BRCA1/2.
Các đặc điểm nhân trắc học và trước khi điều trị nhìn chung cân bằng tốt giữa các nhánh điều trị bằng olaparib và giả dược. Tuổi trung vị là 57 tuổi ở cả hai nhánh; 30% bệnh nhân ≥ 65 tuổi ở nhánh olaparib so với 20% bệnh nhân ở nhánh giả dược. 58% bệnh nhân ở nhánh olaparib và 50% bệnh nhân ở nhánh giả dược là nam. Ở nhánh olaparib, có 89% bệnh nhân người da trắng và 11% bệnh nhân không phải người da trắng; ở nhánh giả dược có 95% bệnh nhân là người da trắng và 5% bệnh nhân không phải người da trắng. Hầu hết bệnh nhân có chỉ số tổng trạng theo ECOG bằng 0 (71% ở nhánh olaparib và 61% ở nhánh giả dược). Nhìn chung, các vị trí di căn trước khi hóa trị là gan 72%, phổi 10% và các vị trí khác 50%. Thời gian trung vị từ thời điểm chẩn đoán ban đầu đến phân ngẫu nhiên vào nghiên cứu trên cả hai nhánh là 6,9 tháng (khoảng 3,6 đến 38,4 tháng).
Nhìn chung, 75% bệnh nhân đã được điều trị FOLFIRINOX với trung vị 9 chu kỳ (khoảng dao động 4-61), 8% được điều trị FOLFOX hoặc XELOX, 4% điều trị với GEMOX, và 3% được điều trị với gemcitabine và cisplatin; 10% bệnh nhân còn lại được điều trị theo phác đồ hóa trị liệu khác. Thời gian điều trị hóa trị liệu bước 1 trên bệnh nhân di căn từ 4-6 tháng, > 6-12 tháng và ≥ 12 tháng, tỷ lệ tương ứng với 77%, 19% và 4% bệnh nhân ở nhánh olaparib và ở 80%, 17 % và 3% ở nhóm giả dược, với thời gian khoảng 1 tháng kể từ khi dùng liều cuối cùng của hóa trị bước 1 cho đến khi tiến hành điều trị thuốc nghiên cứu ở cả 2 nhánh. Về đáp ứng với hóa trị bước 1, 7% bệnh nhân nhánh olaparib và 5% bệnh nhân nhánh giả dược có đáp ứng hoàn toàn, 44% bệnh nhân nhánh olaparib và 44% bệnh nhân nhánh giả dược có đáp ứng một phần và 49% ở nhánh olaparib và 50% bệnh nhân ở nhánh giả dược có tình trạng bệnh ổn định. Tại thời điểm phân ngẫu nhiên, ghi nhận lần lượt 85% và 84% bệnh nhân ở nhánh olaparib và nhánh giả dược có bệnh lý đo lường được. Trung vị thời gian từ thời điểm bắt đầu điều trị hóa trị liệu bước 1 có chứa platinum đến thời đểm phân ngẫu nhiên vào nghiên cứu là 5,7 tháng (khoảng từ 3,4-33,4 tháng).
Tại thời điểm cắt dữ liệu (data cut off - DCO), 33% bệnh nhân ở nhánh olaparib và 13% ở nhánh giả dược vẫn tiếp tục điều trị trong nghiên cứu. 49% bệnh nhân ở nhánh olaparib và 74% bệnh nhân ở nhánh giả dược được dùng liệu pháp điều trị sau đó. 42% bệnh nhân ở nhánh olaparib và 55% bệnh nhân ở nhánh giả dược được dùng liệu pháp điều trị chứa platinum sau đó. 1% bệnh nhân ở nhánh olaparib và 15% bệnh nhân ở nhánh giả dược được dùng liệu pháp chất ức chế PARP sau đó. Trong số 33 (36%) và 28 (45%) bệnh nhân được điều trị với liệu pháp hóa trị liệu tiếp theo lần 1 có chứa platinum sau đó, đã ghi nhận 8 bệnh nhân có tình trạng bệnh ổn định ở nhánh olaparib so với 6 bệnh nhân ở nhánh giả dược, số bệnh nhân có đáp ứng lần lượt là 1 ở olaparib và 2 ở giả dược.
Tiêu chí nghiên cứu chính là thời gian sống bệnh không tiến triển (PFS), được xác định là thời gian từ khi phân ngẫu nhiên vào nghiên cứu cho đến khi bệnh tiến triển, được đánh giá bởi Hội đồng độc lập thẩm định mù trên hình ảnh học (BICR) sử dụng RECIST 1.1 cải tiến để đánh giá những bệnh nhân không có bằng chứng bệnh (no evidence of disease) hoặc tử vong. Tiêu chí hiệu quả phụ bao gồm sống còn toàn bộ (OS), thời gian từ khi phân ngẫu nhiên đến khi bệnh tiến triển lần thứ hai hoặc tử vong (PFS2), thời gian từ khi phân ngẫu nhiên vào nghiên cứu cho đến khi bắt đầu điều trị phác đồ kháng ung thư tiếp theo lần đầu tiên hoặc tử vong (TFST), tỷ lệ đáp ứng khách quan (ORR), thời gian đáp ứng (DoR), tỷ lệ đáp ứng (RR), thời điểm đáp ứng và chất lượng cuộc sống liên quan đến sức khỏe (HRQoL).
Nghiên cứu cho thấy cải thiện đáng kể có ý nghĩa thống kê về PFS ở những bệnh nhân được điều trị bằng olaparib so với những bệnh nhân ở nhánh giả dược (Bảng 9). Đánh giá của BICR về PFS là nhất quán với đánh giá của nghiên cứu viên.
Tại thời điểm phân tích giữa kỳ về tiêu chí OS (46% bệnh nhân xảy ra biến cố) thì HR là 0,91 (95% CI 0,56-1,46; p=0,6833; trung vị 18,9 tháng ở nhánh olaparib so với 18,1 tháng ở nhánh giả dược) không đạt ý nghĩa thống kê. Tỷ số rủi ro HR về PFS2 (47% bệnh nhân xảy ra biến cố, không kiểm soát số bội) là 0,76 (95% CI 0,46-1,23; p=0,2597; trung vị 13,2 tháng ở nhánh olaparib so với 9,2 tháng ở nhánh giả dược).
- xem Bảng 9 và Hình 11.

Ung thư tiền liệt tuyến kháng cắt tinh hoàn di căn có đột biến gen BRCA1/2
Nghiên cứu PROfound
Tính an toàn và hiệu quả của olaparib trên bệnh nhân nam bị ung thư tiền liệt tuyến kháng cắt tinh hoàn di căn (mCRPC) đã được nghiên cứu trong một thử nghiệm pha III, ngẫu nhiên, nhãn mở, đa trung tâm để đánh giá hiệu quả của Lynparza so với nhánh so sánh là tác nhân nội tiết mới (NHA - new hormonal agent) theo lựa chọn của nghiên cứu viên (enzalutamide hoặc abiraterone acetate).
Bệnh nhân cần có bệnh tiến triển trong khi dùng tác nhân nội tiết mới (NHA-new hormonal agent) để điều trị ung thư tiền liệt tuyến di căn và/hoặc bị ung thư tiền liệt tuyến kháng cắt tinh hoàn (CRPC) trước đó. Để được phân vào Cohort A, bệnh nhân cần phải có đột biến gen BRCA1 hoặc BRCA2 dạng nguy hiểm (deleterious) hay nghi ngờ nguy hiểm (suspected deleterious). Bệnh nhân có đột biến gen ATM (ataxia telangiecsia mutated) cũng được phân ngẫu nhiên vào Cohort A, nhưng không thể chứng minh được nguy cơ - lợi ích trong quần thể nhóm bệnh nhân này. Những bệnh nhân có các đột biến gen khác được phân ngẫu nhiên vào Cohort B.
Trong nghiên cứu này, 387 bệnh nhân được phân chia ngẫu nhiên theo tỷ lệ 2:1 để điều trị với olaparib (300 mg [2 x viên nén 150 mg] hai lần mỗi ngày) hoặc thuốc so sánh. Có 245 bệnh nhân trong Cohort A (162 dùng olaparib và 83 dùng thuốc so sánh) và Cohort B có 142 bệnh nhân (94 dùng olaparib và 48 dùng thuốc so sánh). Bệnh nhân được phân tầng dựa trên việc đã dùng taxane và có bằng chứng về bệnh lý đo lường được. Tiếp tục điều trị cho đến khi bệnh tiến triển. Bệnh nhân phân ngẫu nhiên vào nhóm thuốc so sánh được phép chuyển sang nhóm olaparib sau khi có bệnh tiến triển được xác nhận bởi BICR trên hình ảnh học. Bệnh nhân có đột biến BRCA1, BRCA2 phát hiện trong khối u thông qua xác nhận tiến cứu bằng xét nghiệm trung tâm, ngoài trừ 3 bệnh nhân thông qua xét nghiệm tại địa phương. Trong số 160 bệnh nhân có đột biến BRCA1 hoặc BRCA2 của nghiên cứu PROfound, có 114 bệnh nhân được xét nghiệm hồi cứu để xác nhận đột biến BRCA1/2 có nguồn gốc dạng di truyền hay dạng mắc phải. Ở những bệnh nhân này, 63 người có đột biến BRCA1/2 được xác định từ mẫu máu và do đó được xác định là do di truyền. 51 bệnh nhân còn lại có đột biến BRCA1/2 trong khối u, không được xác định dương tính từ mẫu máu và vì vậy xác nhận là đột biến BRCA1/2 có nguồn gốc dạng mắc phải. Không rõ nguồn gốc đột biến dạng di truyền hay mắc phải đối với 46 bệnh nhân còn lại.
Các đặc điểm nhân trắc học và trước khi điều trị nhìn chung cân bằng tốt giữa nhánh điều trị bằng olaparib và nhánh thuốc đối chứng trên bệnh nhân có đột biến BRCA1/2. Tuổi trung vị là 68 tuổi và 67 tuổi lần lượt ở nhánh dùng olaparib và thuốc so sánh. Ở nhánh olaparib, liệu pháp điều trị trước đó là taxane (71%), enzalutamide (41%), abiraterone acetate (37%) và phối hợp enzalutamide và abiraterone acetate (20%). Nhóm so sánh có liệu pháp điều trị trước đó bao gồm taxane (60%), enzalutamide (50%), abiraterone acetate (36%) và phối hợp enzalutamide với abiraterone acetate (14%). 58% bệnh nhân ở nhánh olaparib và 55% bệnh nhân ở nhánh so sánh có bệnh lý đo lường được trước khi vào nghiên cứu. Tỷ lệ bệnh nhân di căn xương, hạch bạch huyết, hô hấp và gan lần lượt là 89%, 62%, 23% và 12% ở nhánh olaparib và lần lượt là 86%, 71%, 16% và 17% ở nhánh so sánh. Hầu hết bệnh nhân có chỉ số tổng trạng theo ECOG bằng 0 hoặc 1 (93%) ở cả 2 nhánh. Điểm đau tại thời điểm ban đầu dựa trên Thang điểm đánh giá mức độ đau - Biểu mẫu vắn tắt (Brief Pain Inventory Short Form, BPI-SF worst pain) là 0-< 2 (52%), 2-3 (10%) hoặc > 3 (34%) ở nhánh olaparib và 0-< 2 (45%), 2-3 (7%) hoặc > 3 (45%) ở nhánh so sánh. Trung vị kháng nguyên đặc hiệu tuyến tiền liệt (PSA - Prostate-specific antigen) tại thời điểm ban đầu là 57,48 µg/L ở nhánh olaparib và 103,95 µg/L ở nhánh so sánh.
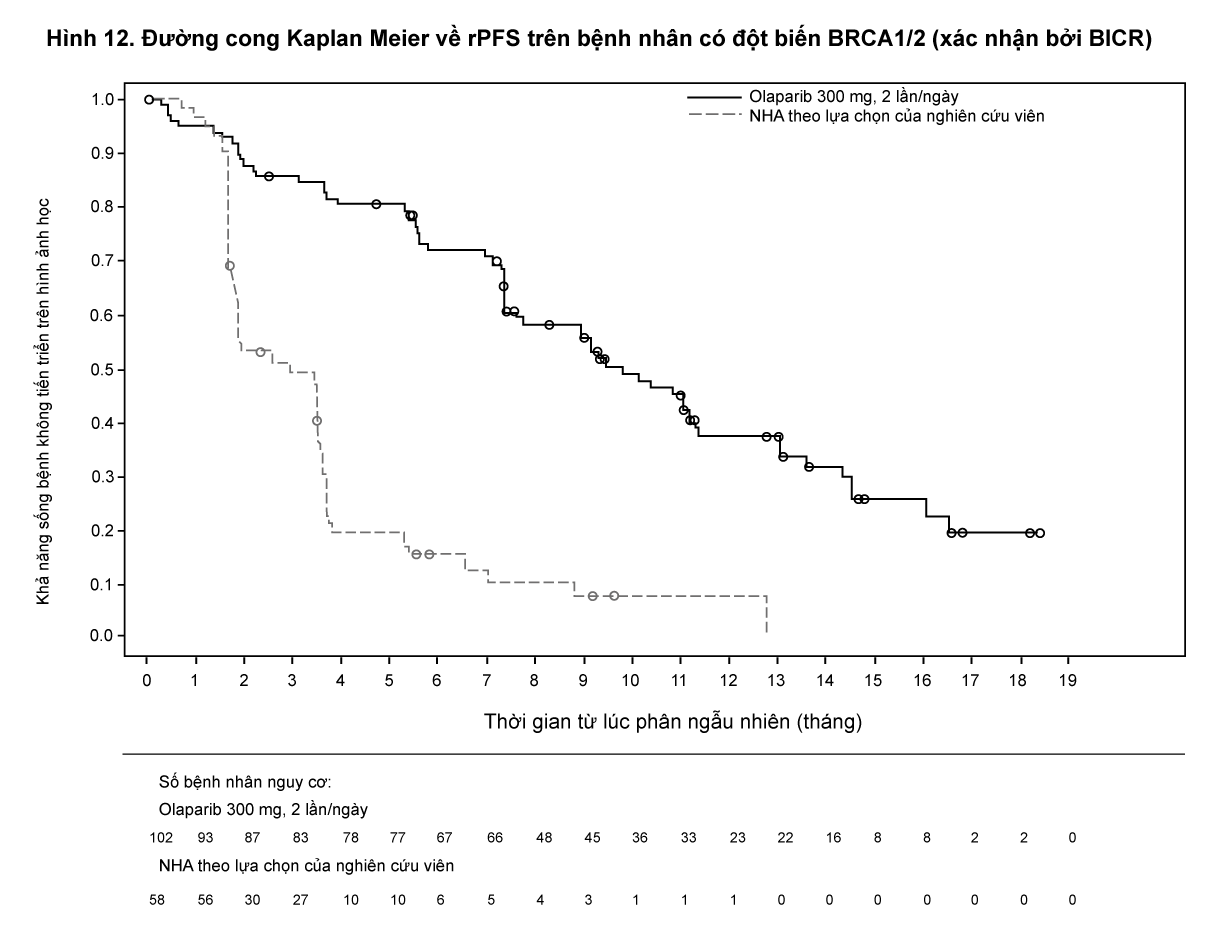
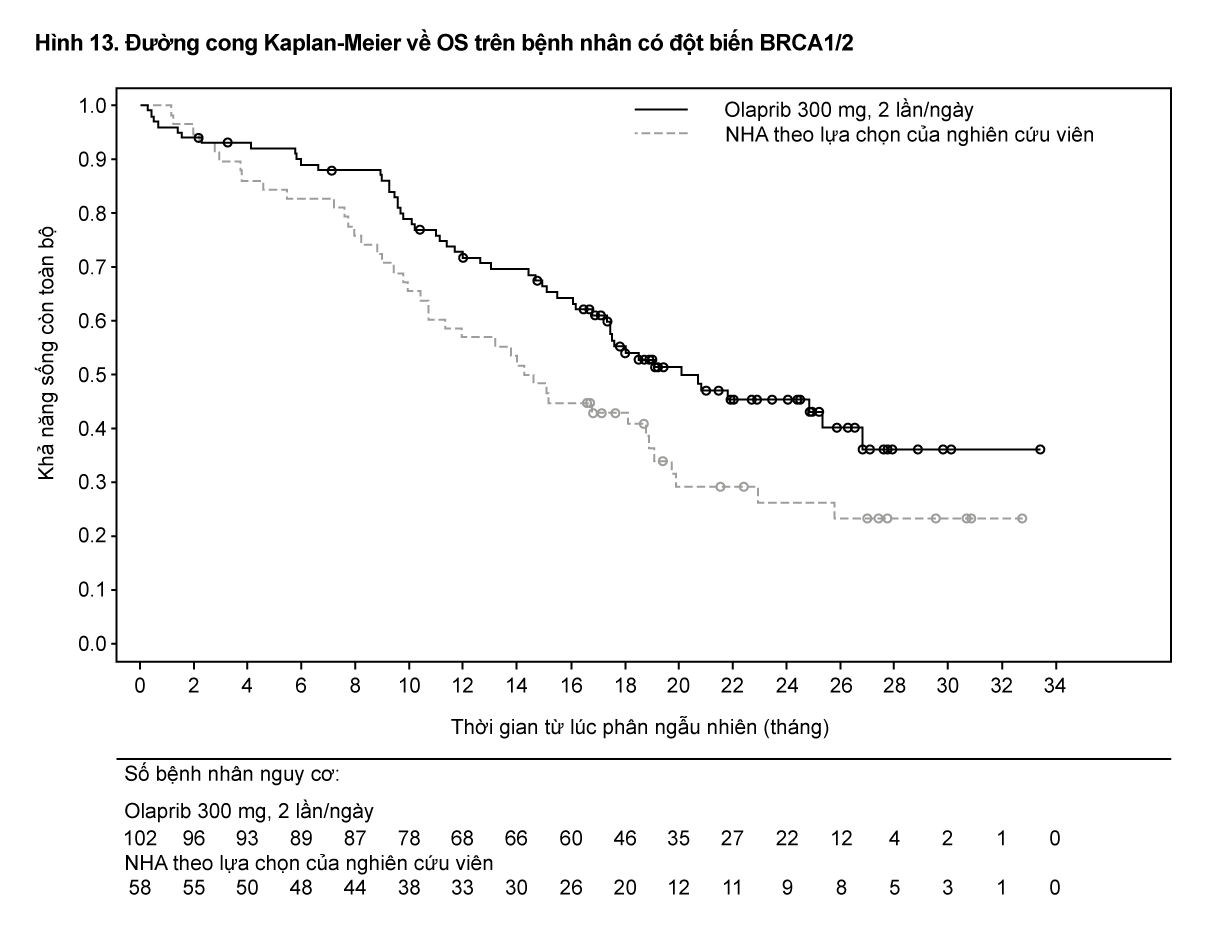
Tiêu chí nghiên cứu chính là thời gian sống bệnh không tiến triển trên hình ảnh học (rPFS) ở nhóm Cohort A được đánh giá bởi Hội đồng độc lập thẩm định mù trên hình ảnh học (BICR) sử dụng RECIST 1.1 (trên mô mềm) và tiêu chuẩn Nhóm làm việc ung thư tuyến tiền liệt-3 (Prostate Cancer Working Group - PCWG3) (trên xương). Tiêu chí hiệu quả phụ bao gồm tỷ lệ đáp ứng khách quan (ORR) được xác nhận bởi BICR, thời gian sống bệnh không tiến triển trên hình ảnh học (rPFS) xác nhận bởi BICR, thời gian đến khi cơn đau tiến triển (TTPP) và sống còn toàn bộ (OS).
Nghiên cứu cho thấy sự cải thiện đáng kể có ý nghĩa thống kê về rPFS theo đánh giá của BICR, OS cuối cùng ở nhánh olaparib so với nhánh thuốc so sánh trong Cohort A.
Kết quả trên bệnh nhân có đột biến BRCA1/2 được trình bày trong Bảng 10. Có sự cải thiện đáng kể có ý nghĩa thống kê về rPFS được đánh giá bởi BICR trên bệnh nhân có đột biến BRCA1/2 ở nhánh olaparib so với nhánh điều trị bằng tác nhân nội tiết mới (new hormonal agent) theo lựa chọn của nghiên cứu viên. Phân tích sau cùng về OS cho thấy sự cải thiện về OS có ý nghĩa thống kê định danh (nominally statistically significant) trên bệnh nhân có đột biến BRCA1/2 được phân ngẫu nhiên điều trị với Lynparza so với thuốc so sánh.
- xem Bảng 10, Hình 12 & 13.





 Đăng xuất
Đăng xuất

