Biểu hiện của phối tử gây chết tế bào theo lập trình (programmed cell death ligand 1 (PD-L1) có thể sinh ra từ các tín hiệu viêm (ví dụ, IFN-gamma) và có thể biểu hiện trên cả tế bào khối u và các tế bào miễn dịch liên quan đến khối u trong môi trường vi mô của khối u. PD-L1 ngăn chặn chức năng tế bào T và kích hoạt thông qua tương tác với PD-1 và CD80 (B7.1). Bằng cách liên kết với các thụ thể của nó, PD-L1 làm giảm hoạt tính tế bào T gây độc tế bào, tăng sinh và sản xuất cytokine.
Durvalumab là một kháng thể đơn dòng ức chế miễn dịch G1 kappa của người (IgG1κ) gắn với PD-L1 và ngăn chặn sự tương tác của PD-L1 với PD-1 và CD80 (B7.1). Sự phong tỏa các tương tác PD-L1/ PD-1 và PD-L1/ CD80 giải phóng sự ức chế phản ứng miễn dịch, mà không gây độc tế bào phụ thuộc vào kháng thể tế bào (ADCC).
Sự phong tỏa PD-L1 với durvalumab dẫn đến tăng hoạt hóa tế bào T trong ống nghiệm và giảm kích thước khối u trong khối u của người đồng ghép (co-engrafted human tumor) và mô hình ghép ngoại lai trên tế bào miễn dịch của chuột (immune cell xenograft mouse models).
Dược lực học
AUC, Ctrough và Cmax ở trạng thái ổn định ở những bệnh nhân sử dụng liều 1.500 mg 4 tuần một lần có tỉ lệ tương ứng là cao hơn 6%, thấp hơn 19% và cao hơn 55% so với những bệnh nhân sử dụng liều 10 mg/kg 2 tuần một lần. Dựa trên mô hình dữ liệu dược động học và mối tương quan nồng độ và thời gian tiếp xúc với thuốc so với tính an toàn, không có sự khác biệt có ý nghĩa về mặt lâm sàng về hiệu quả và tính an toàn đối với liều 1.500 mg 4 tuần một lần so với liều 10 mg/kg 2 tuần một lần ở bệnh nhân NSCLC có cân nặng > 30 kg.
Ung thư phổi không tế bào nhỏ (NSCLC)
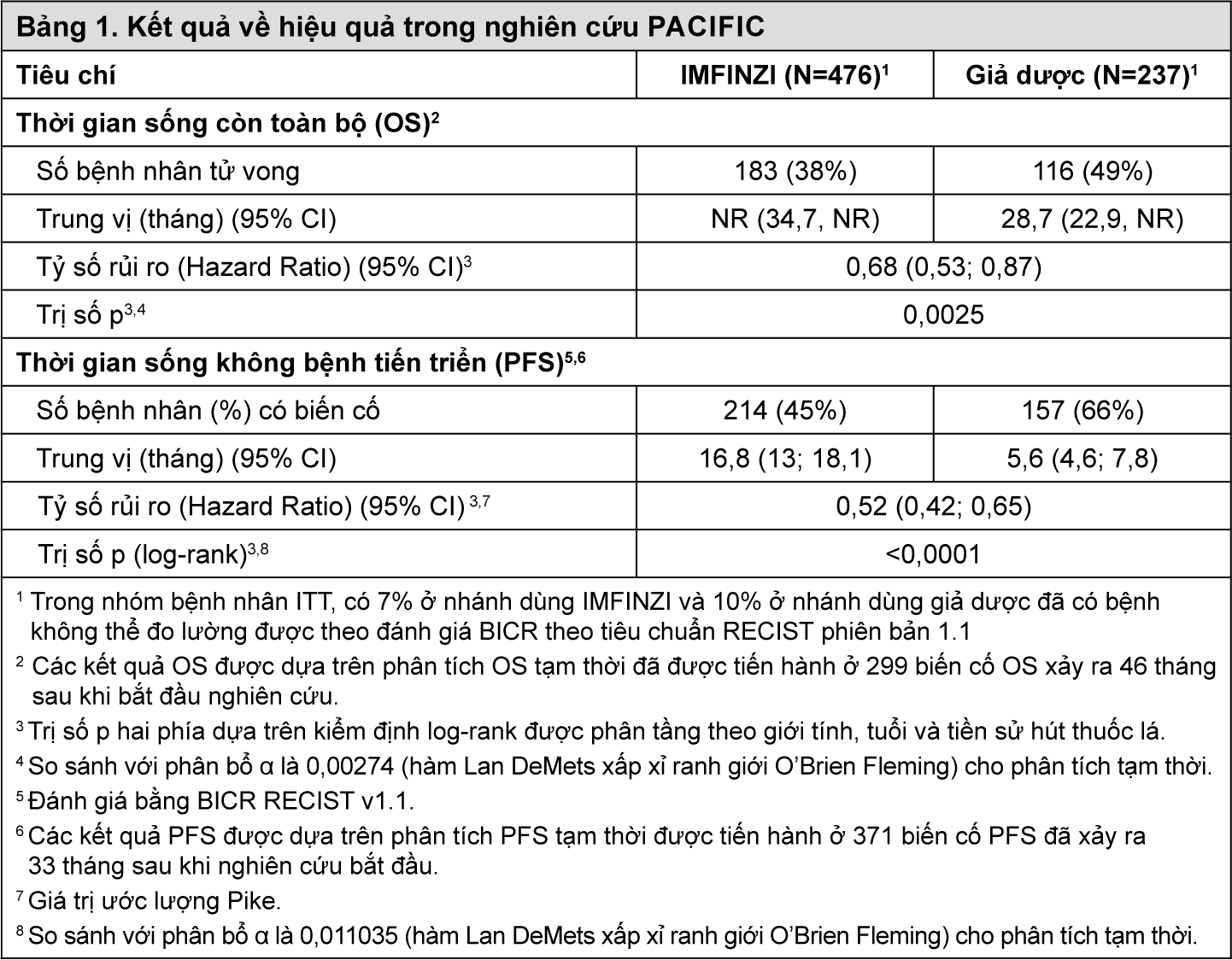
Hiệu quả của IMFINZI được đánh giá trong nghiên cứu PACIFIC (NCT02125461), một nghiên cứu đa trung tâm, ngẫu nhiên, mù đôi, đối chứng với giả dược trên bệnh nhân NSCLC giai đoạn III không thể phẫu thuật, đã hoàn thành ít nhất 2 chu kỳ hóa trị đồng thời có platinum kết hợp với xạ trị tiệt căn trong 42 ngày trước khi bắt đầu dùng thuốc nghiên cứu và có thể trạng theo thang điểm của WHO là 0 hoặc 1. Nghiên cứu loại trừ những bệnh nhân đã tiến triển bệnh sau khi dùng liệu pháp hóa xạ trị đồng thời, bệnh nhân có bệnh tự miễn thể hoạt động trước đó hoặc ghi nhận trong vòng 2 năm từ khi bắt đầu nghiên cứu hoặc bệnh nhân có tình trạng y khoa yêu cầu dùng thuốc ức chế miễn dịch toàn thân. Bệnh nhân được phân ngẫu nhiên theo giới tính, tuổi tác (< 65 tuổi so với ≥ 65 tuổi) và tiền sử hút thuốc (hút thuốc so với người không hút thuốc). Bệnh nhân được phân ngẫu nhiên theo tỷ lệ 2:1 để nhận IMFINZI 10 mg/kg hoặc giả dược, tiêm tĩnh mạch 2 tuần một lần trong tối đa 12 tháng hoặc cho đến khi xuất hiện độc tính không thể chấp nhận hoặc xác định bệnh tiến triển theo Tiêu chuẩn đánh giá đáp ứng trên bướu đặc (RECIST 1.1). Việc đánh giá tình trạng khối u được thực hiện 8 tuần một lần. Các tiêu chí hiệu quả chính là thời gian sống không bệnh tiến triển (progression-free survival PFS) được đánh giá bởi BICR RECIST 1.1 và thời gian sống còn toàn bộ (Overall survival OS). Các tiêu chí bổ sung về hiệu quả bao gồm tỷ lệ đáp ứng khách quan (Objective response rate – ORR) đánh giá theo Hội đồng độc lập thẩm định mù (BICR).
Tổng cộng có 713 bệnh nhân được phân ngẫu nhiên bao gồm 476 bệnh nhân trong nhánh dùng IMFINZI và 237 bệnh nhân dùng giả dược. Đặc điểm dân số nghiên cứu là: tuổi trung bình 64 năm (trong khoảng: 23 đến 90); 70% nam giới; 69% người da trắng và 27% người châu Á; 16% người đang hút thuốc, 75% người đã từng hút thuốc lá và 9% người không bao giờ hút thuốc; 51% bệnh nhân có thể trạng theo WHO là 1; 53% bệnh nhân ở giai đoạn IIIA và 45% ở giai đoạn IIIB; 46% mô học có vảy (squamous) và 54% với mô học không vảy (non-squamous). Tất cả bệnh nhân được xạ trị tiệt căn theo nguyên tắc per protocol, trong đó 92% nhận được tổng liều bức xạ 54 Gy đến 66 Gy; 99% bệnh nhân được điều trị bằng hóa trị liệu có platinum đồng thời (55% hóa trị liệu cisplatin, 42% hóa trị liệu carboplatin và 2% chuyển đổi giữa cisplatin và carboplatin).
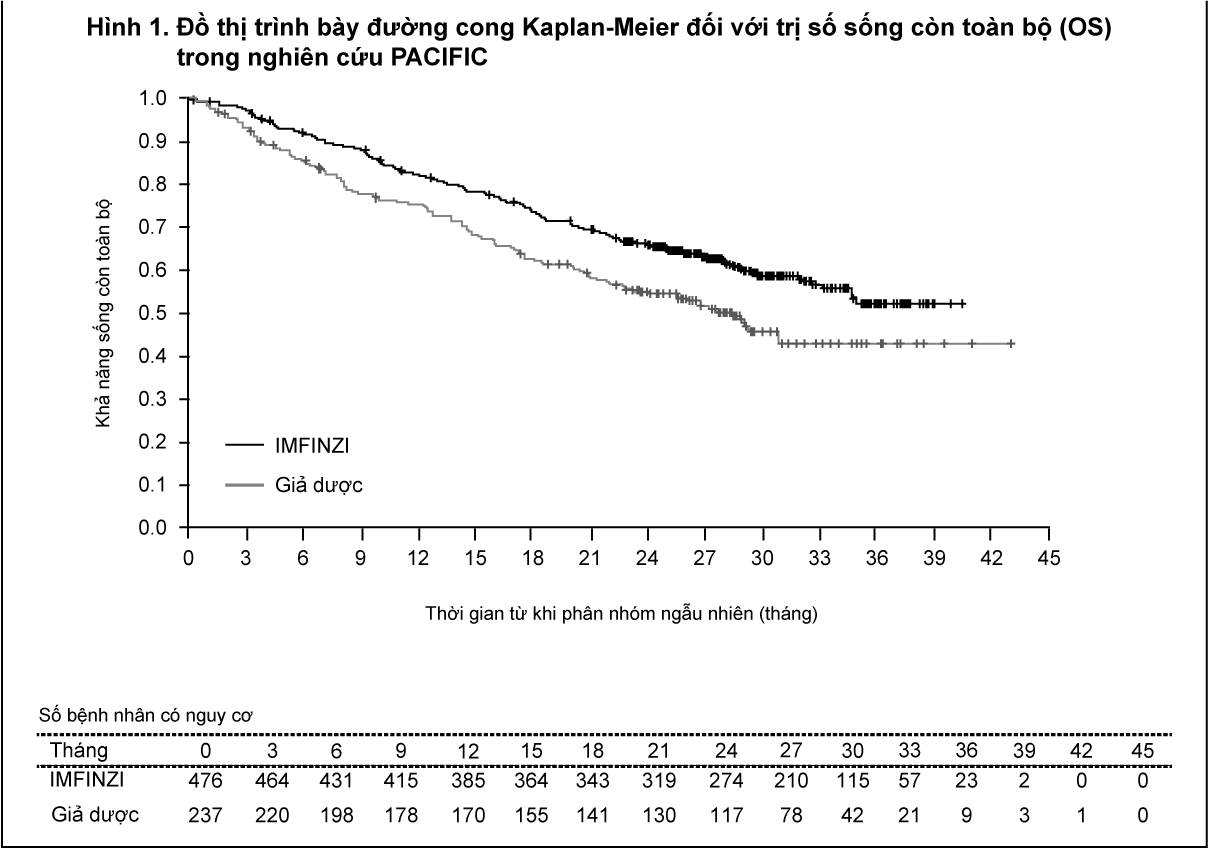
Tại lần phân tích OS tạm thời được định trước dựa trên 299 biến cố (61% tổng số biến cố dự kiến), nghiên cứu đã chứng minh cải thiện có ý nghĩa thống kê về OS ở những bệnh nhân được phân ngẫu nhiên dùng IMFINZI so với nhóm dùng giả dược. Phân tích PFS tạm thời được xác định trước dựa trên 371 biến cố (81% tổng biến cố dự kiến) đã chứng minh có cải thiện đáng kể về mặt thống kê về PFS ở những bệnh nhân được phân ngẫu nhiên dùng thuốc IMFINZI so với nhóm dùng giả dược. Bảng 1 và Hình 1. Tóm tắt các kết quả về hiệu quả của thuốc trong nghiên cứu PACIFIC.
- xem Bảng 1 & Hình 1.
Ung thư phổi tế bào nhỏ (SCLC)
Hiệu quả của IMFINZI trong phối hợp với etoposide và carboplatin hoặc cisplatin ở bệnh nhân ES-SCLC chưa được điều trị trước đó đã được nghiên cứu trong thử nghiệm CASPIAN, một thử nghiệm ngẫu nhiên nhãn mở, đa trung tâm, có đối chứng (NCT03043872). Những bệnh nhân đủ điều kiện có điểm đánh giá thể trạng theo WHO (WHO performance status) là 0 hoặc 1 và phù hợp để điều trị bằng phác đồ hóa trị có platinum như liệu pháp bước 1 để điều trị SCLC. Bệnh nhân di căn não mà không có triệu chứng hoặc đã được điều trị có thể tham gia nghiên cứu. Việc lựa chọn phác đồ hóa chất platinum nào là do nghiên cứu viên quyết định, có xem xét đến độ thanh thải creatinine. Các bệnh nhân sau không đủ điều kiện tham gia nghiên cứu: có tiền sử xạ trị vùng ngực; tiền sử suy giảm miễn dịch nguyên phát thể hoạt động; rối loạn miễn dịch tự miễn bao gồm hội chứng cận ung thư (paraneoplastic); rối loạn viêm hoặc bệnh tự miễn thể hoạt động hoặc đã được ghi nhận trước đó; sử dụng thuốc ức chế miễn dịch toàn thân trong vòng 14 ngày trước liều điều trị đầu tiên ngoại trừ corticosteroid toàn thân ở liều sinh lý.
Việc phân nhóm ngẫu nhiên được phân tầng dựa trên liệu pháp hóa trị platinum được lên kế hoạch trước trong chu kỳ 1 (carboplatin hoặc cisplatin).
Việc đánh giá hiệu quả trong điều trị ES-SCLC dựa trên sự so sánh giữa:
- IMFINZI 1.500 mg, và phác đồ carboplatin (AUC 5 hoặc 6 mg/mL/phút) hoặc cisplatin (75-80 mg/m2) theo lựa chọn của nghiên cứu viên vào Ngày 1 và etoposide (80-100 mg/m2) tiêm tĩnh mạch vào Ngày 1, 2, và 3 của mỗi chu kỳ 21 ngày trong 4 chu kỳ, tiếp theo là IMFINZI 1.500 mg mỗi 4 tuần cho đến khi bệnh tiến triển hoặc xuất hiện độc tính không thể chấp nhận được, hoặc
- Phác đồ carboplatin (AUC 5 hoặc 6 mg/mL/phút) hoặc cisplatin (75-80 mg/m2) theo lựa chọn của nghiên cứu viên vào Ngày 1 và etoposide (80-100 mg/m2) tiêm tĩnh mạch vào Ngày 1, 2 và 3 của mỗi Chu kỳ 21 ngày, tối đa 6 chu kỳ. Sau khi hoàn thành hóa trị liệu, có thể chiếu xạ dự phòng (PCI) tùy theo quyết định của nghiên cứu viên.
Cho phép điều trị IMFINZI đơn trị qua tiến triển nếu bệnh nhân được nghiên cứu viên xác định đạt được ổn định về mặt lâm sàng và tiếp tục nhận được lợi ích lâm sàng.
Tiêu chí đánh giá hiệu quả chính là thời gian sống còn toàn bộ (OS) của IMFINZI kết hợp với hóa trị so với hóa trị đơn thuần. Tiêu chí bổ sung đánh giá hiệu quả là thời gian sống không bệnh tiến triển (PFS) do nghiên cứu viên đánh giá và tỷ lệ đáp ứng khách quan (ORR), theo RECIST v1.1.
Đặc điểm dân số nghiên cứu: tuổi trung vị là 63 (khoảng 28 tới 82); có 40% bệnh nhân từ 65 tuổi trở lên; 70% giới tính nam; 84% chủng tộc da trắng, 15% chủng tộc Châu Á và 0,9% chủng tộc da đen; 65% có điểm thể trạng theo WHO/ECOG là 1; và 93% là người hút thuốc trước đây/hiện tại. 90% bệnh nhân mắc bệnh Giai đoạn IV và 10% đã bị di căn não tại thời điểm bắt đầu. Tổng cộng 25% bệnh nhân được điều trị bằng cisplatin và 74% bệnh nhân được điều trị bằng carboplatin. Riêng trong nhóm chỉ dùng hóa trị, có 57% bệnh nhân được hóa trị 6 chu kỳ và 8% bệnh nhân được chiếu xạ dự phòng (PCI).
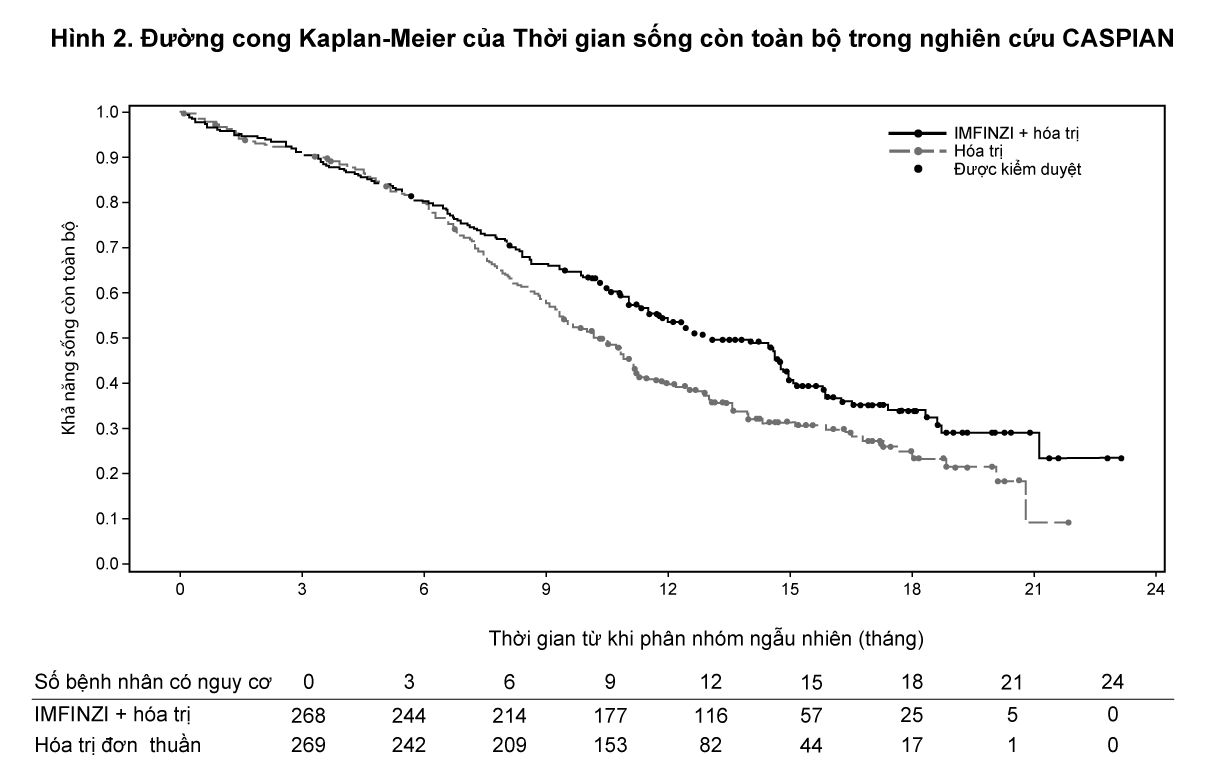
Kết quả của thời gian sống còn toàn bộ OS được tóm tắt trong Bảng 2 và Hình 2.
- xem Bảng 2 & Hình 2.

PFS theo đánh giá của nghiên cứu viên (96% tổng biến cố dự kiến) cho thấy tỷ số rủi ro (HR) là 0,78 (95% CI: 0,65; 0,94), với PFS trung vị là 5,1 tháng (95% CI: 4,7, 6,2) ở nhóm IMFINZI kết hợp hóa trị và 5,4 tháng (95% CI: 4,8, 6,2) ở nhóm hóa trị đơn độc. ORR được xác nhận theo đánh giá của nghiên cứu viên là 68% (95 CI %: 62%; 73%) ở nhóm IMFINZI kết hợp hóa trị và 58% (95% CI: 52%; 63%) ở nhóm hóa trị đơn độc.
Trong các phân tích phân nhóm thăm dò của OS dựa trên phác đồ hóa trị có platinum được lên kế hoạch điều trị ở chu kỳ 1, tỷ số rủi ro là 0,70 (95% CI 0,55; 0,89) ở phân nhóm bệnh nhân điều trị bằng carboplatin và tỷ số rủi ro là 0,88 (95% CI 0,55; 1,41) ở phân nhóm bệnh nhân điều trị bằng cisplatin.




 Đăng xuất
Đăng xuất

