Đối với IMFINZI đơn trị liệu, tính an toàn dựa trên dữ liệu tổng hợp ở 3.006 bệnh nhân mắc những bệnh ung thư khác nhau. IMFINZI được dùng với liều 10 mg/kg mỗi 2 tuần hoặc 20 mg/kg mỗi 4 tuần. Các tác dụng ngoại ý thường gặp nhất (> 10%) gồm ho/ ho có đờm (21,5%), tiêu chảy (16,3%), phát ban (16,0%), sốt rét (13,8%), nhiễm trùng đường hô hấp trên (13,5%), đau bụng (12,7%), ngứa (10,8%), và suy tuyến giáp (10,1%).
Tính an toàn của IMFINZI trong phối hợp với hóa trị dựa trên dữ liệu ở 265 bệnh nhân SCLC. IMFINZI được sử dụng ở liều 1.500 mg mỗi 3 tuần kết hợp với hóa trị, sau đó là đơn trị liệu mỗi 4 tuần một lần. Các tác dụng ngoại ý thường gặp nhất (> 20%) gồm giảm bạch cầu trung tính (48,7%), thiếu máu (38,5%), buồn nôn (33,6%), mệt mỏi (32,1%), rụng tóc (31,3%), giảm tiểu cầu (21,1%), và giảm bạch cầu (20,0%).
Bảng phân loại các phản ứng ngoại ý
Bảng 4 liệt kê tỷ lệ phản ứng ngoại ý trong bộ dữ liệu an toàn đơn trị liệu của IMFINZI và trên những bệnh nhân được điều trị phối hợp IMFINZI với hóa trị trong nghiên cứu CASPIAN. Các phản ứng ngoại ý của thuốc được liệt kê theo hệ cơ quan trong MedDRA. Trong mỗi hệ cơ quan, các phản ứng ngoại ý của thuốc được trình bày theo tần suất giảm dần. Các loại tần suất tương ứng cho mỗi ADR được định nghĩa như sau: rất thường gặp (≥ 1/10); thường gặp (≥ 1/100 đến < 1/10); không thường gặp (≥ 1/1.000 đến < 1/100); hiếm gặp (≥ 1/10.000 đến < 1/1.000); rất hiếm gặp (< 1/10.000); không được biết (không thể ước tính từ dữ liệu có sẵn). Trong mỗi nhóm tần suất, phản ứng ngoại ý của thuốc được trình bày theo thứ tự mức độ nghiêm trọng giảm dần.
- xem Bảng 5.
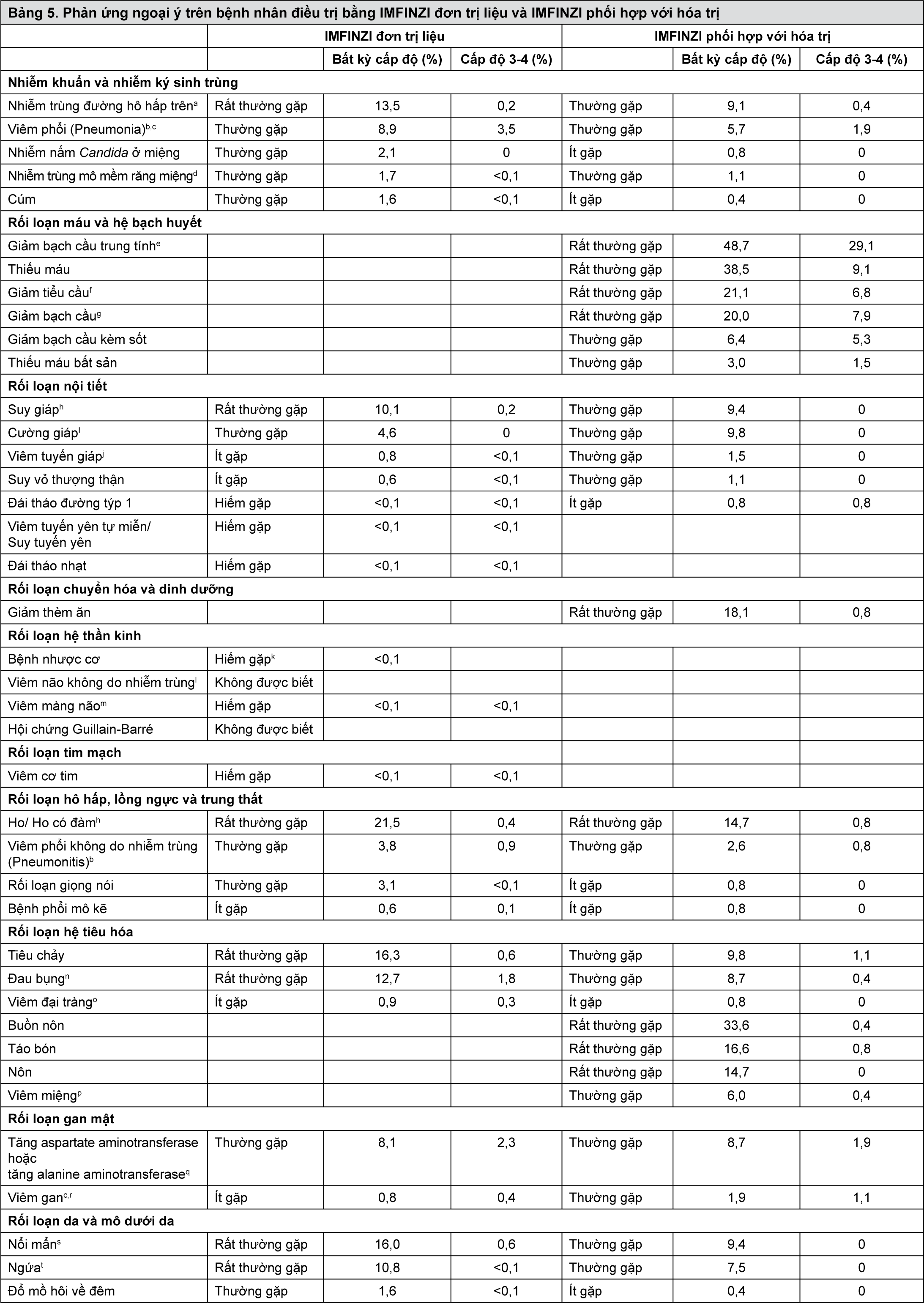

Mô tả các phản ứng ngoại ý chọn lọc
IMFINZI chủ yếu liên quan tới các phản ứng ngoại ý liên quan đến miễn dịch. Hầu hết các phản ứng này kể cả các phản ứng ngoại ý nặng sẽ được cải thiện sau khi bắt đầu điều trị y tế thích hợp hoặc ngưng dùng IMFINZI. Dữ liệu cho các phản ứng ngoại ý liên quan đến miễn dịch sau đây được trình bày từ cơ sở dữ liệu tổng hợp về tính an toàn của 3.006 bệnh nhân bao gồm nghiên cứu PACIFIC và các nghiên cứu bổ sung ở những bệnh nhân với các khối u rắn khác nhau trong các chỉ định chưa được phê duyệt của durvalumab. Trong tất cả các nghiên cứu, IMFINZI được dùng với liều 10 mg/kg mỗi 2 tuần, 20 mg/kg mỗi 4 tuần, hoặc 1.500 mg mỗi 3 hoặc 4 tuần. Thông tin chi tiết về các phản ứng ngoại ý đáng kể của IMFINZI khi dùng phối hợp với hóa trị được trình bày nếu có ghi nhận có khác biệt có ý nghĩa về mặt lâm sàng khi so sánh với IMFINZI đơn trị. Các hướng dẫn quản lý cho các phản ứng ngoại ý này được mô tả trong phần Cảnh báo và thận trọng.
Viêm phổi không do nhiễm trùng (pneumonitis) liên quan đến miễn dịch
Trong cơ sở dữ liệu tổng hợp về tính an toàn với đơn trị liệu IMFINZI (n = 3.006 trên nhiều loại khối u), viêm phổi không do nhiễm trùng liên quan đến miễn dịch xảy ra ở 107 (3,6%) bệnh nhân, bao gồm 23 (0,8%) bệnh nhân cấp độ 3, 2 (< 0,1%) bệnh nhân cấp độ 4, và 6 (0,2%) bệnh nhân cấp độ 5. Thời gian trung vị khởi phát là 57 ngày (khoảng: 2-785 ngày). Sáu mươi bốn trong số 107 bệnh nhân được điều trị bằng corticosteroid liều cao (ít nhất 40 mg prednisone hoặc tương đương mỗi ngày), và 2 bệnh nhân cũng được điều trị với infliximab và 1 bệnh nhân điều trị với cyclosporine. Ngưng dùng IMFINZI ở 38 bệnh nhân. Hồi phục (resolution) xảy ra ở 58 bệnh nhân.
Viêm phổi không do nhiễm trùng liên quan đến miễn dịch xảy ra thường xuyên hơn trong nghiên cứu PACIFIC trên nhóm bệnh nhân đã kết thúc hóa xạ trị đồng thời trong vòng 1 đến 42 ngày trước khi bắt đầu nghiên cứu (10,7%), so với các bệnh nhân khác trong dữ liệu an toàn kết hợp (2,2%).
Trong nghiên cứu PACIFIC với số bệnh nhân n = 475 ở nhóm IMFINZI và n = 234 ở nhóm giả dược, đã ghi nhận viêm phổi không do nhiễm trùng liên quan đến miễn dịch xảy ra ở 51 (10,7%) bệnh nhân trong nhóm điều trị IMFINZI và 16 (6,8%) bệnh nhân trong nhóm giả dược, trong đó cấp độ 3 có 8 (1,7%) bệnh nhân ở nhóm IMFINZI so với 6 (2,6%) bệnh nhân ở nhóm dùng giả dược và cấp độ 5 (tử vong) có 4 (0,8%) bệnh nhân dùng IMFINZI so với 3 (1,3%) bệnh nhân dùng giả dược. Thời gian trung vị khởi phát trong nhóm điều trị IMFINZI là 53 ngày (khoảng thời gian từ 1-341 ngày) so với 55,5 ngày (khoảng thời gian 0-231 ngày) trong nhóm giả dược. Trong nhóm điều trị với IMFINZI, có 44 trong số 51 bệnh nhân phải dùng corticosteroids toàn thân, bao gồm 28 bệnh nhân được điều trị bằng corticosteroid liều cao (ít nhất 40 mg prednisone hoặc tương đương mỗi ngày), và 2 bệnh nhân cũng được dùng infliximab. Trong nhóm giả dược, có 11 trong số 16 bệnh nhân phải dùng corticosteroids toàn thân, bao gồm 9 bệnh nhân được điều trị bằng corticosteroid liều cao (liều tối thiểu 40 mg prednisone hoặc tương đương mỗi ngày). Hồi phục (resolution) xảy ra ở 27 bệnh nhân ở nhóm điều trị bằng IMFINZI so với 6 ở nhóm giả dược.
Viêm gan liên quan đến miễn dịch
Trong cơ sở dữ liệu tổng hợp về tính an toàn với đơn trị liệu IMFINZI, viêm gan liên quan đến miễn dịch xảy ra ở 36 bệnh nhân (1,2%), bao gồm 19 (0,6%) bệnh nhân cấp độ 3, 1 (< 0,1%) bệnh nhân ở cấp độ 4 và 2 (< 0,1%) bệnh nhân ở cấp độ 5 (tử vong). Thời gian trung vị khởi phát là 67 ngày (trong khoảng: 7-333 ngày). Hai mươi lăm trong số 36 bệnh nhân được điều trị bằng corticosteroid liều cao (liều tối thiểu 40 mg prednisone hoặc tương đương mỗi ngày). Hai bệnh nhân cũng được điều trị bằng mycophenolate. Ngưng dùng IMFINZI ở 7 bệnh nhân. Hồi phục (resolution) xảy ra ở 22 bệnh nhân.
Viêm đại tràng do trung gian miễn dịch
Trong cơ sở dữ liệu tổng hợp về tính an toàn với đơn trị liệu IMFINZI, viêm đại tràng do trung gian miễn dịch hoặc tiêu chảy xảy ra ở 52 (1,7%) bệnh nhân, bao gồm 9 (0,3%) bệnh nhân cấp độ 3 và 2 (< 0,1%) bệnh nhân cấp độ 4. Thời gian trung vị khởi phát là 73 ngày (trong khoảng: 1-394 ngày). Có 34 trong số 52 bệnh nhân được điều trị bằng corticosteroid liều cao (liều tối thiểu 40 mg prednisone hoặc tương đương mỗi ngày). Một bệnh nhân cũng được điều trị infliximab và 1 bệnh nhân được điều trị bằng mycophenolate. 9 bệnh nhân ngưng dùng IMFINZI. Hồi phục (resolution) xảy ra ở 39 bệnh nhân.
Bệnh nội tiết liên quan đến miễn dịch
Suy giáp liên quan đến miễn dịch
Trong cơ sở dữ liệu tổng hợp về tính an toàn với đơn trị liệu IMFINZI, suy giáp liên quan đến miễn dịch xảy ra ở 222 (7,4%) bệnh nhân, bao gồm 4 (0,1%) bệnh nhân cấp độ 3. Thời gian trung vị khởi phát là 85 ngày (khoảng: 1-562 ngày). Trong số 222 bệnh nhân, có 218 bệnh nhân được điều trị nội tiết thay thế và 5 bệnh nhân dùng corticosteroids liều cao (liều tối thiểu 40 mg prednisone hoặc tương đương mỗi ngày) cho bệnh lý suy giáp liên quan đến miễn dịch sau khi áp dụng liệu pháp thay thế nội tiết. Không có bất kỳ bệnh nhân nào ngưng dùng IMFINZI do suy giáp liên quan đến miễn dịch.
Cường giáp liên quan đến miễn dịch
Trong cơ sở dữ liệu tổng hợp về tính an toàn với đơn trị liệu IMFINZI, cường giáp liên quan tới miễn dịch xảy ra ở 43 (1,4%) bệnh nhân, không có trường hợp nào ở cấp độ 3 hoặc 4. Thời gian trung vị khởi phát là 43 ngày (khoảng: 1-196 ngày). Ba mươi chín trong số 43 bệnh nhân được điều trị nội khoa (thiamazole, carbimazole, propylthiouracil, perchlorate, chẹn kênh calci hoặc chẹn beta), 11 bệnh nhân được điều trị bằng corticosteroid toàn thân và 4 trong số 11 bệnh nhân được điều trị corticosteroid toàn thân liều cao (liều tối thiểu 40 mg prednisone hoặc tương đương mỗi ngày). Một bệnh nhân ngưng dùng IMFINZI do cường giáp. Hồi phục xảy ra ở 35 bệnh nhân. Mười tám bệnh nhân bị suy giáp sau cường giáp.
Viêm tuyến giáp liên quan đến miễn dịch
Trong cơ sở dữ liệu tổng hợp về tính an toàn với IMFINZI đơn trị liệu, viêm tuyến giáp liên quan đến miễn dịch xảy ra ở 11 (0,4%) bệnh nhân, gồm có 2 (< 0,1%) bệnh nhân ở cấp độ 3. Thời gian trung vị khởi phát là 41 ngày (khoảng: 14-106 ngày). Trong số 11 bệnh nhân, có 9 bệnh nhân được điều trị bằng liệu pháp thay thế hormone, 1 bệnh nhân được điều trị bằng corticosteroid liều cao (liều thấp nhất 40 mg prednisone hoặc tương đương mỗi ngày) sau liệu pháp thay thế hormone. Một bệnh nhân ngưng điều trị IMFINZI do viêm tuyến giáp liên quan đến miễn dịch. Hai bệnh nhân bị suy giáp sau khi viêm tuyến giáp.
Suy thượng thận liên quan đến miễn dịch
Trong cơ sở dữ liệu tổng hợp về tính an toàn với đơn trị liệu IMFINZI, suy thượng thận liên quan đến miễn dịch xảy ra ở 12 (0,4%) bệnh nhân, bao gồm 3 (< 0,1%) bệnh nhân cấp độ 3. Thời gian trung vị khởi phát là 145,5 ngày (khoảng: 20-547 ngày). Tất cả 12 bệnh nhân đều dùng thuốc corticosteroid toàn thân; có 4 trong số 12 bệnh nhân được điều trị bằng corticosteroid liều cao (liều tối thiểu 40 mg prednisone hoặc tương đương mỗi ngày). Không có bệnh nhân nào ngưng dùng IMFINZI do suy thượng thận liên quan đến miễn dịch. Hồi phục (resolution) xảy ra ở 3 bệnh nhân.
Đái tháo đường týp 1 liên quan đến miễn dịch
Trong cơ sở dữ liệu tổng hợp về tính an toàn với đơn trị liệu IMFINZI, tiểu đường týp 1 liên quan đến miễn dịch đã xảy ra ở 1 (< 0,1%) bệnh nhân (cấp độ 3). Thời gian khởi phát là 43 ngày. Bệnh nhân này được điều trị bằng liệu pháp nội tiết và ngưng dùng IMFINZI do bị đái tháo đường týp 1. Bệnh nhân đã được hồi phục.
Viêm tuyến yên tự miễn/ Suy tuyến yên liên quan đến miễn dịch
Trong cơ sở dữ liệu tổng hợp về tính an toàn kết hợp với đơn trị liệu IMFINZI, viêm tuyến yên liên quan đến miễn dịch xảy ra ở 2 (< 0,1%) bệnh nhân (cả hai đều ở cấp độ 3). Thời gian khởi phát đối với các tác dụng không mong muốn này lần lượt là 44 ngày và 50 ngày. Cả hai bệnh nhân này được điều trị bằng corticosteroid liều cao (liều tối thiểu 40 mg prednisone hoặc tương đương mỗi ngày) và một bệnh nhân ngưng dùng IMFINZI do viêm tuyến yên/suy tuyến yên liên quan đến miễn dịch.
Viêm thận liên quan đến miễn dịch
Trong cơ sở dữ liệu tổng hợp về tính an toàn với đơn trị liệu IMFINZI, viêm thận liên quan đến miễn dịch xảy ra ở 9 (0,2%) bệnh nhân, bao gồm 2 (< 0,1%) bệnh nhân cấp độ 3. Thời gian trung vị khởi phát là 87 ngày (khoảng: 29-393 ngày). Sáu (0,2%) bệnh nhân được điều trị bằng corticosteroid liều cao (liều tối thiểu 40 mg prednisone hoặc tương đương mỗi ngày) và 1 bệnh nhân điều trị bằng mycophenolate. Năm bệnh nhân ngưng dùng IMFINZI. Hồi phục (resolution) xảy ra ở 6 bệnh nhân.
Nổi mẩn liên quan đến miễn dịch
Trong cơ sở dữ liệu tổng hợp về tính an toàn với đơn trị liệu IMFINZI, nổi mẩn hoặc viêm da liên quan đến miễn dịch (bao gồm bọng nước Pemphigoid) xảy ra ở 45 (15%) bệnh nhân, bao gồm 12 (0,4%) bệnh nhân ở cấp độ 3. Thời gian trung vị khởi phát là 41 ngày (khoảng: 4-333 ngày). Có 20 trong số 45 bệnh nhân được điều trị bằng corticosteroid liều cao (ít nhất 40 mg prednisone hoặc tương đương mỗi ngày). IMFINZI đã được ngưng ở 3 bệnh nhân. Hồi phục (resolution) xảy ra ở 31 bệnh nhân.
Phản ứng do truyền thuốc
Trong dữ liệu an toàn kết hợp với đơn trị liệu IMFINZI, các phản ứng liên quan đến truyền dịch xảy ra ở 49 (1,6%) bệnh nhân, bao gồm 5 (0,3%) bệnh nhân độ 3. Không có biến cố ngoại ý ở cấp độ 4 hoặc 5.
Bất thường trên thông số xét nghiệm cận lâm sàng
Trên bệnh nhân được điều trị với durvalumab đơn trị liệu, tỷ lệ bệnh nhân có sự thay đổi bất thường trong thông số xét nghiệm từ mức ban đầu lên độ 3 hoặc 4 như sau: 2,4% đối với tăng alanin aminotransferase, 3,6% đối với tăng aspartate aminotransferase, 0,5% đối với tăng creatinine máu, 5,7% đối với tăng amylase và 5,6% đối với tăng lipase. Tỷ lệ bệnh nhân có sự thay đổi TSH từ mức độ ban đầu ≤ ULN sang mức độ > ULN ở bất kỳ cấp độ nào là 18,8% và TSH chuyển từ mức độ ban đầu ≥ LLN sang mức độ < LLN ở bất kỳ cấp độ nào là 18,1%.
Ở những bệnh nhân điều trị bằng durvalumab phối hợp với hóa trị, tỷ lệ bệnh nhân có sự thay đổi bất thường trong kết quả xét nghiệm cận lâm sàng từ mức bình thường sang cấp độ 3 hoặc 4 như sau: 4,9% đối với tăng alanine aminotransferase, 4,6% đối với tăng aspartate aminotransferase, 3,4% đối với tăng creatinine máu, 4,8% đối với tăng amylase và 8,1% đối với tăng lipase. Tỷ lệ bệnh nhân có sự thay đổi TSH từ mức độ ban đầu ≤ ULN sang mức độ > ULN ở bất kỳ cấp độ nào là 17,7% và TSH chuyển từ mức độ ban đầu ≥ LLN sang mức độ < LLN ở bất kỳ cấp độ nào là 31,3%.
Tính sinh miễn dịch
Khả năng sinh miễn dịch của IMFINZI đơn trị liệu dựa trên dữ liệu tổng hợp ở 2.280 bệnh nhân được điều trị bằng IMFINZI đơn trị liệu với liều 10 mg/kg mỗi 2 tuần hoặc 20 mg/kg mỗi 4 tuần và đánh giá sự hiện diện của kháng thể kháng thuốc (ADA). Sáu mươi chín bệnh nhân (3,0%) có kết quả xét nghiệm dương tính đối với ADA phát sinh trong quá trình điều trị. Các kháng thể trung hòa (nAb) kháng lại durvalumab được phát hiện ở 0,5% (12/2.280) bệnh nhân. Sự hiện diện của ADA không có ảnh hưởng liên quan đến lâm sàng trên tính an toàn. Không có đủ số bệnh nhân để xác định tác động của ADA đối với tính hiệu quả. Dựa trên phân tích trên dân số PK, tỷ lệ giảm nhẹ tiếp xúc được dự đoán trên bệnh nhân ADA dương tính, việc giảm nhẹ tiếp xúc dược động học (PK) là dưới 30% so với bệnh nhân điển hình và không được xem là có liên quan lâm sàng.
Trong nghiên cứu CASPIAN, trong 201 bệnh nhân được điều trị bằng IMFINZI 1.500 mg mỗi 3 tuần phối hợp với hóa trị và đánh giá sự hiện diện của ADA, không (0%) bệnh nhân có kết quả xét nghiệm dương tính đối với ADA phát sinh trong quá trình điều trị. Tác động của ADA phát sinh trong quá trình điều trị đối với dược động học, tính an toàn và hiệu của durvalumab trên lâm sàng chưa được đánh giá vì không có mẫu bệnh phẩm nào dương tính với ADA phát sinh trong quá trình điều trị bằng durvalumab
Người cao tuổi
Không có sự khác biệt tổng thể về độ an toàn được ghi nhận ở người cao tuổi (≥ 65 tuổi) và bệnh nhân trẻ hơn. Dữ liệu trên bệnh nhân NSCLC và ES-SCLC ≥ 75 tuổi còn hạn chế.
Báo cáo phản ứng ngoại ý nghi ngờ
Việc báo cáo các phản ứng ngoại ý nghi ngờ sau khi thuốc được cấp phép lưu hành là quan trọng. Điều này cho phép tiếp tục theo dõi sự cân bằng giữa nguy cơ/lợi ích của thuốc. Cán bộ y tế được yêu cầu báo cáo bất kỳ tác dụng không mong muốn nào qua hệ thống báo cáo quốc gia.
View ADR Monitoring Form




 Đăng xuất
Đăng xuất

